(1)有关生活常识的说法中正确的是 (填序号)。
①活性炭可用做冰箱除味剂
②纯净水中不含任何化学物质
③“低碳”是指较低的二氧化碳排放
④提倡购物时少用塑料袋或不用塑料袋,以减少“白色污染”。
(2)现有托盘天平、药匙、烧杯、玻璃棒、胶头滴管、试剂瓶,若要配制50克溶质质量分数为6%的NaCl溶液,还需要的仪器是 。
(3)如果将浓硫酸、浓盐酸敞口放置在空气中一段时间后,它们的溶质质量分数分别将会 。
下图是A、B、C三种物质的溶解度曲线,下列分析不正确的是
A.50℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时把50gA放入100g水中能得到A的饱和溶液,其中溶质与溶剂的质量比为1:2
C.将C的饱和溶液变为不饱和溶液,一般可采用降温的方法
D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,所得三种溶液的溶质质量分数的大小关系是B>A=C
小华同学配制50g溶质质量分数为20%的NaCl溶液,操作流程如下图:
(1)小华同学应称取氯化钠的质量是 。
(2)指出上图中的一处错误: 。
(3)在用量筒量取水的过程中,当液面接近刻度线时,他的操作如图所示,其中规范的是 (填序号)。
(4)若小华配制的氯化钠溶液的溶质质量分数小于20%,则造成此误差的可能原因有 (填序号)。
A.砝码生锈
B.称量纸上残留少量食盐
C.向烧杯中加水时,有少量水溅出
如图为市售盐酸标签的部分内容,其中36.0%~38.0%表示该盐酸中
| A.氯元素含量 | B.溶质溶解度 |
| C.溶质的式量 | D.溶质质量分数 |
实验小组的甲、乙两同学配制溶液,甲欲配制100g 15%的氯化钠溶液,乙欲用98%的浓硫酸(ρ=1.84g/mL)配制50g 10%的稀硫酸,下列有关说法正确的是( )
| A.甲、乙两同学都一定用到托盘天平 |
| B.乙同学溶解时,需将水缓缓加入浓硫酸中 |
| C.乙同学需量取45g 水 |
| D.若甲同学仰视取液,所得溶液质量分数偏小 |
下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图: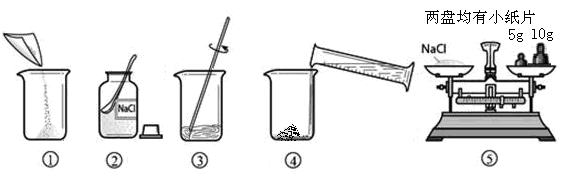
(1)用上图表示的序号表示配制溶液的正确操作顺序_______________________。
(2)图②中,有一种塑料仪器,其名称是___________。
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则称取的NaCl质量为 。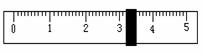
(4)根据计算需要量取水的体积是 (水的密度为1g/mL)。量取读数时,视线应与 齐平。
下图是小华同学用氢氧化钠固体和水配制500g溶质质量分数2.5%的NaOH溶液的操作过程,该同学在称量氢氧化钠时,先将天平调节平衡,然后在两个托盘上各放一张质量相同的纸,把药品直接放在纸上称量。
(1)根据上述实验,请回答:
①a操作的错误是 。
②下列操作中导致溶质质量分数偏低的是 (填字母)。
| A.a操作中砝码和氢氧化钠放错盘 |
| B.b中烧杯用水洗涤后未干燥就使用 |
| C.c操作中视线与量筒凹液面最低处保持水平 |
| D.d操作中有少量水溅出 |
(2)小华在测定所配制溶液的酸碱度时,先将pH试纸用蒸馏水湿润,再进行测定,则测的溶液的pH值______(选填“偏大”、“偏小”或“不受影响”).
(3)小华将上述溶液稀释成0.2%做电解水实验,用 检验正极产生的气体。若将100g稀释后的氢氧化钠溶液电解,实验后溶液中氢氧化钠的质量分数变为0.25%,有 g水被电解。(已知氢氧化钠可增强水的导电性,在通电前后质量不变)
请你参与配制一定溶质质量分数的氢氧化钠溶液,并进行有关计算。
(1)小红同学在实验室欲配制10%的氢氧化钠溶液143g,请回答:
①配制 10%的氢氧化钠溶液143g,需要40%的氢氧化钠溶液(密度为1.43g/cm3) mL,加水 mL
(结果保留一位小数)。
②实验中,必需用到的仪器有 。
(2)将一定质量的二氧化碳通入 200g10%的氢氧化钠溶液中,恰好完全反应,反应的化学方程式为 ,生成的碳酸钠的质量是 g。
下列配制一定溶质质量分数的氯化钠溶液实验操作失误,会引起质量分数降低的是
| A.用托盘天平称量3.2g氯化钠时,误将砝码放在左盘,并使用游码 |
| B.用量筒量取水时,面对刻度线俯视凹液面的最低处 |
| C.将量筒中的水倒入烧杯时,有水溅出 |
| D.将配好的溶液转移到细口瓶时,不慎洒落。 |
要配制100g20%的NaOH溶液。下列操作正确的是
| A.称量前调节天平平衡时发现指针向右偏转,可调节游码 |
| B.溶解时直接用温度计搅拌不仅可以加快溶解速度,还能证明NaOH溶于水放热 |
| C.将准确称取的NaOH固体直接倒入装有水的量筒中溶解 |
| D.选用量筒量取水时,量筒中本来有少量水对于所配得溶液的浓度无影响 |
下图是甲、乙两种固体物质的溶解度曲线,回答下列相关问题。
(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么,t1℃时,200g水中溶解 g乙,溶液达到饱和。
(2)t2℃时,比较甲、乙两物质的溶解度大小: 。
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是 (只写一种)
(4)若将t10C 时的甲物质的饱和溶液200克和乙物质的饱和溶液400克分别升温到t2 0C(不考虑水分蒸发)两物质的溶液中溶质的质量分数的关系是:甲 乙(填大于、小于或等于)。
将l00g质量分数为20%的硝酸钾溶液稀释为5%的硝酸钾营养液,需要加水的质量为
| A.l00g | B.200g | C.300g | D.400g |
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)t1℃时,甲物质的溶解度 (填“大于”、“小于”或“等于”)乙物质的溶解度。
(2)t1℃时,100g水中最多能溶解丙物质 g。
(3)t2℃时,把等质量的甲、乙两物质的饱和溶液降温到t1℃,析出晶体较多的是 。
(4)t2℃时,向盛有100g水的烧杯中加入60g甲物质,充分溶解后,所得溶液溶质的质量分数是 (计算结果精确到0.1%)。
研究表明,木糖醇是一种理想的蔗糖替代品,它具有甜味足、溶解性好、防龋齿,适合糖尿病患者食用的优点。根据木糖醇和蔗糖的溶解度曲线,下列叙述不正确的是
| A.木糖醇和蔗糖都是易溶物 |
| B.30℃时两种物质的溶液溶质质量分数相等 |
| C.60℃时,40g木糖醇加入50g水,能得到90g溶液 |
| D.在人体正常体温时,木糖醇溶解度大于蔗糖 |
把12g某固体放入90g水中,充分搅拌,有2g固体未溶解,则所得溶液的溶质质量分数是( )
| A.10% | B.11.7% | C.12% | D.13.3% |