溶液是生产生活中常见的物质,依据相关信息回答问题:
资料:硝酸钾的溶解度数据(部分数据已做取整数处理)如下表所示:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
| 溶解度/g |
21 |
32 |
46 |
64 |
86 |
110 |
138 |
(1)农业上,硝酸钾用作水溶性肥料,为作物补充氮和钾元素。硝酸钾溶液中的溶质是______。
(2)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示。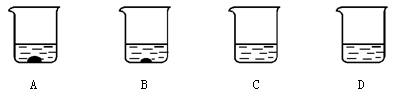
①(填字母序号)中盛的一定是饱和溶液。
②使B烧杯的溶液升温至50℃时,溶液的质量为g。
③采用一种方法使A中的固体恰好溶解。对于最终四个烧杯中的溶液,下列说法正确的是(填字母序号)。
a.溶剂质量可能相等
b.溶质质量可能相等
c.溶质质量分数可能有相等的
d.烧杯A中的溶液质量分数可能最大
(3)工业上利用电解饱和氯化钠溶液可制得重要化工产品氢氧化钠。氢氧化钠溶液可用于治理含二氧化硫的废气并回收二氧化硫,反应的主要流程如下: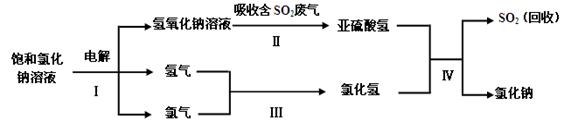
①实际生产中,在一定温度下,配制100t溶质的质量分数为25%的饱和氯化钠溶液,需水的质量为t。
②以上流程中,可循环使用的物质是。
③亚硫酸氢钠(NaHSO3)中硫元素的质量分数为%(计算结果精确到0.1%)。
(15分)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验。
一、铁红制备的流程图分析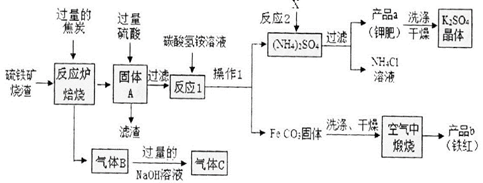
(1)写出焙烧中CO与Fe203反应的化学方程式_。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和_(填仪器名称)
(3)你认为对气体C最佳的处理方法是_。
A.冷却后排入空气 B.燃烧后排放 C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是_。
(5)反应2中相关物质的溶解度如下表。你认为该反应在常温下能实现的原因是。
洗涤干燥得到K2S04晶体时,可选用下列__(填字母)洗涤剂;
A.KCl的饱和溶液 B.水 C.K2S04的饱和溶液
为检验K2S04晶体是否洗涤干净,可取最后一次洗涤液,先加入_(选填序号,下同),
振荡、静置,再向上层清液中滴加_,观察现象即可判断。
A.AgN03溶液 B.过量的BaCl2溶液 C.过量的Ba(N03)2溶液
二、铁红的性质实验
【问题讨论】
【资料1】草酸晶体(H2C204·3H20)在浓H2S04作用下受热分解,化学方程式为:
H2C2O4·3H2O C02↑+C0↑+4H20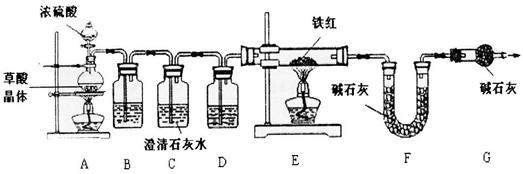
(6)实验前应先_。
(7)进入E中的气体是纯净、干燥的CO,则B、D中的试剂依次是__、___(填字母编号)。
A.浓硫酸 B.澄清的石灰水 C.氢氧化钠溶液
(8)C装置的作用是。
【数据分析与计算】
用SDTQ600热分析仪对氧化铁(Fe2O3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如下图。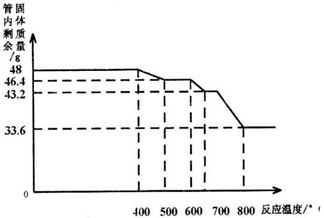
【资料2】已知铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁。
(9)800℃以上时,管内固体成分的化学式为;
(10)写出管内固体质量由48g变为46.4g时反应的化学方程式_。
【实验评价】
请指出【问题讨论】中实验装置的一个明显缺陷。