根据下面的实验过程和提供的数据,可知样品中碳的质量分数为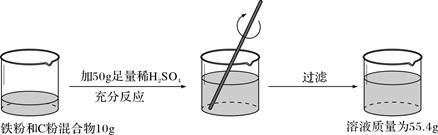
| A.44% | B.46% | C.54% | D.64% |
某气体样品可能含有NO、N2O5、NO2中的一种或几种,经实验测定该样品中,氮、氧两种元素的质量比为7:16。其样品的组成不可能是
| A.NO、NO2和N2O5 | B.N2O5和NO |
| C.N2O5和NO2 | D.NO2 |
现有一定质量的甲烷不完全燃烧,生成一氧化碳、二氧化碳和水蒸气的混合气体75g,经测定混合气体中碳元素的质量分数为16%,则参加反应的氧气的质量是
| A.48g | B.56g | C.59g | D.64g |
向盛有碳酸钙粉末的试管中加入足量的稀盐酸,完全反应后共收集到 二氧化碳气体,试计算反应消耗的碳酸钙的质量.
某石灰石样品中含有不含钙元素的杂质,测得该石灰石样品中含钙的质量分数为36%,该样品中碳酸钙的质量分数为( )
| A. |
36% |
B. |
40% |
C. |
72% |
D. |
90% |
现有100g过氧化氢溶液,测得其中含氢元素的质量分数为8%,加入8gCuSO4作催化剂
制取氧气,充分反应后所得溶液(无晶体析出)中溶质的质量分数为
| A.7.4% | B.10% | C.8% | D.11.1% |
现有铜和氧化铜的混合物22.4g,加入某质量分数的稀盐酸至恰好完全反应,所用稀盐酸质量100g,将反应后的固液混合物过滤,得到滤液116g,则该混合物中铜元素的质量分数为
| A.28.6% | B.85.7% | C.87.5% | D.71.4% |
草莓、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质。下列关于乙酸乙酯的说法正确的是( )
| A.该物质是由4个碳元素 、8个氢元素和2个氧元素组成的 |
| B.1个乙酸乙酯分子中含有4个水分子 |
| C.乙酸乙酯中碳、氢、氧的质量比为4:8:2 |
| D.乙酸乙酯燃烧有二氧化碳和水生成 |
某硝酸铵样品,经测定含氮量为25%,已知该样品中只含有一种杂质,则该样品可能混有下列物质中的
| A.NH4 Cl | B.(NH4)2SO4 | C.CO(NH2)2 | D.NH4HCO3 |
取7.8g锌与铜的混合物与49.0g稀硫酸恰好完全反应,产生氢气的物质的量与时间关系如图所示。
①计算样品中所含锌的质量 (20) (根据化学方程式列式计算);
②反应后溶液中溶质的质量分数为 (21) (计算结果精确到0.1%)。
制造口罩时,常用环氧乙烷(C 2H 4O)灭菌。常温下,环氧乙烷和乙烯(C 2H 4)按一定质量比混合的气体中碳元素的质量分数是72%.下列有关该混合气体的说法不正确的是( )
| A. |
碳元素与氢元素的质量之比是6:1 |
| B. |
氢元素的质量分数是12% |
| C. |
氧元素的质量分数是28% |
| D. |
环氧乙烷与乙烯的分子数之比是1:2 |
下列说法中正确的是( )
A.质量相等的氧化铁和四氧化三铁中,氧元素的质量比为80:87
B.碳酸钠和氯化钠的固体混合物22.3g,其中含氧元素4.8g,则该混合物中氯元素的质量为7.1g
C.某氮的氧化物中,氮、氧元素的质量比为7:12,则该氧化物的化学式为N2O5
D.某过氧化氢溶液中氢元素与氧元素的质量比为2:17,向38g该溶液中加入1g二氧化锰,充分反应后,生成2g氧气
下列说法中正确的是( )
A.质量相等的氧化镁和硫酸镁中镁元素的质量比为3:1
B.质量相等的硫和碳分别在氧气中充分燃烧,硫比碳消耗氧气的质量大
C.硝酸铵和氯化钾的混合物中氮元素质量分数为14%,该混合物中硝酸铵的质量分数为40%
D.质量和质量分数均相等的氢氧化钠溶液和稀硫酸,充分反应后,向所得溶液中滴加硫酸铜溶液,不会出现蓝色沉淀
现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中()
| A. | 碳酸钠消耗的氯化氢多 | B. | 碳酸氢钠生成的二氧化碳多 |
| C. | 碳酸氢钠消耗的氯化氢多 | D. | 碳酸氢钠生成的二氧化碳多 |