工业上以石灰石为原料制备碳酸钙的工艺流程如图1。
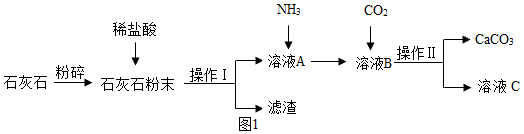
回答下列问题:
(1)石灰石粉末与稀盐酸反应的化学方程式是 。实验室发生该反应时,发生装置(如图2)应选用 (填字母序号,下空同),收集气体时应选用 。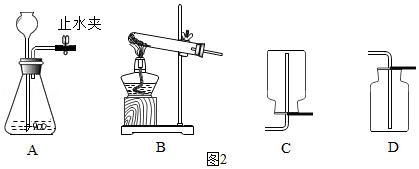
(2)操作Ⅰ和操作Ⅱ为同一操作,其名称是 。该操作需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)溶液A中先通入NH3的目的是提供碱性环境,增大CO2的溶解量,促使反应进行。
①通CO2时,在溶液B中生成CaCO3,该反应的化学方程式是 。
②为使溶液B中的物质顺利转化为CaCO3,除了通NH3外,还可加入 (填字母序号)。
A.NaCl
B.NaOH
C.KOH
D.Ca(OH)2
中国科学院张青莲院士对铟、铱、锗等的相对原子质量测定作出了杰出贡献。锗是重要的半导体材料,由锗精矿(含GeO2、GeS2、As2O3等)制备金属锗的步骤如下:
①焙烧,GeS2转化为GeO2,然后用盐酸溶解得到GeCl4.②用Cl2将杂质转化为不易挥发的H3AsO4.③加热混合溶液使GeCl4气化,再冷凝为液态,经过一系列转化得到GeO2.④用H2将GeO2还原为Ge,同时H2转化为H2O。
(1)步骤①盐酸溶解GeO2的化学方程式为 。
(2)完成步骤②除杂反应的化学方程式:AsCl3+4H2O+Cl2═H3AsO4+5 。
(3)步骤③分离GeCl4的方法是 (填标号)。
A.过滤
B.蒸馏
C.升华
D.蒸发
(4)步骤④消耗H2和生成Ge的质量之比为 。
已知:NaOH溶液能与MgSO4溶液反应生成Na2SO4和难溶于水的Mg(OH)2.镁大多是从海水中提取。某小组从预先处理后的海水中提取镁的主要步骤如图:

(1)沉淀时,NaOH应过量的目的是 。
(2)过滤时,使用玻璃棒的作用是 。
(3)溶解时,稀盐酸与Mg(OH)2发生反应的化学方程式为 ,该反应的反应类型为 。
某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如图:
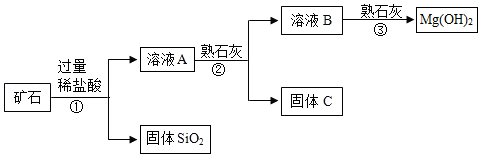
回答下列问题:
(1)步骤①和步骤②均用到的操作是 。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和 (填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 |
Fe3+ |
Cu2+ |
Mg2+ |
开始沉淀时的pH |
1.9 |
4.2 |
9.1 |
完全沉淀时的pH |
3.2 |
6.7 |
11.1 |
步骤②加入熟石灰,调节溶液的pH范围为 ,固体C中所含成分的化学式为 。
(4)步骤③制得Mg(OH)2的化学方程式为 。
硝酸钙可用于无土栽培等。一种利用石灰石制备硝酸钙晶体的流程如图:
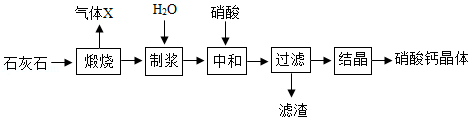
已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”所得的混合物属于 (填字母)。
a.溶液 b.悬浊液 c.乳浊液
(3)写出“中和”步骤主要反应的化学方程式: 。
(4)工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和 。
(5)“制浆”时须控制好加入水的量。加入水量太少会导致制浆困难;加入水量太多会导致 。
(6)若省去“制浆”步骤也可制得硝酸钙。但硝酸利用率会降低,同时会产生污染气体NOx.产生NOx的原因是 。
高氯酸钾(KClO4)是一种性能稳定的物质,主要用作发烟剂、引火剂、氧化剂和化学分析试剂,工业生产上生产的高氯酸钾的工艺流程如图:

回答下列问题:
(1)为加快氯酸钾的溶解,可采取的措施为 。
(2)流程中的分离操作相当于实验室中的 。
(3)反应釜中发生的化学反应方程式为 ,该反应属于基本反应类型中的 反应。
(4)电解NaClO3溶液时,除产生NaClO4外,还得到一种清洁的高能燃料,该反应的化学方程式为 。
以MnO2为原料制备MnSO4•H2O的工业流程如图。
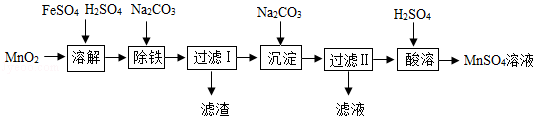
已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO3•6Mn(OH)2•5H2O↓+7Na2SO4+6CO2↑
②MnSO4•H2O和MnSO4•5H2O易溶于水,难溶于乙醇。
③MnSO4的溶解度曲线如图1所示。
(1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、 、 。水浴加热的优点有 。能加快溶解的方法有 (写一种)。
(2)除铁时需要搅拌,搅拌的作用是 。
(3)过滤I所得滤液的溶质主要是Na2SO4和 。过滤时,玻璃棒的作用是 。
(4)酸溶时,MnCO3•6Mn(OH)2•5H2O与足量稀硫酸反应的化学方程式为 。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4•H2O的实验方案:将MnSO4溶液转移至蒸发皿中, ,在高于40℃时趁热过滤, ,100℃烘干得MnSO4•H2O。
无水氯化钙(CaCl 2)是重要的干燥剂,CaCl 2•6H 2O与冰的混合物是实验室常用的制冷剂,将CaCl 2•6H 2O加热可得CaCl 2.某工厂以石灰石为原料生产无水氯化钙的流程如图所示,原料石灰石中含有的杂质主要是MgCO 3、MgSO 4。

(1)过滤和蒸发均用到的玻璃仪器是 。
(2)石灰石溶解时,杂质MgCO 3发生反应的化学方程式为 ,该反应是 (填基本反应类型)
(3)加入BaCl 2溶液除去的杂质离子是 ,加入氢氧化钙溶液除杂的化学方程式为 。
(4)由CaCl 2•6H 2O得到CaCl 2是 变化(填"物理"或"化学")。
实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3•3H2O.其主要实验过程如图:

已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为 和 。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有 (填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。 (填“能”或“否”),理由是 。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是 。
以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如图

注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为 (填化学式)。
(2)实验室中用图一所示装置进行过滤。
①该装置中仪器A的名称为 。
②若过滤时滤液出现浑浊,可能的原因是 (填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3•H2O发生反应。结合图二,写出该反应的化学方程式 。
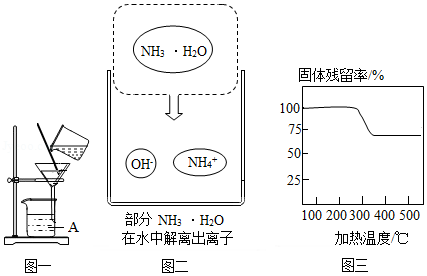
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如题图三所示。“加热”时温度至少要达到350℃,原因是 。
中国古代四大发明之一的"黑火药"是由木炭(C)、硫粉(S)和硝酸钾(KNO 3)按一定比例混合而成。
(1)分类。下列关于"黑火药"说法正确的是 。
a."黑火药"由"黑火药分子"构成
b."黑火药"中的KNO 3属于复合肥料
c."黑火药"中的C、S不再保持各自的化学性质
(2)变化。"黑火药"爆炸时发生的主要反应是:S+2KNO 3+3C═K 2S+N 2↑+3 ↑。
①依据质量守恒定律,空格上缺少的物质是 (填化学式)。
②"黑火药"爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为 。
(3)制备。古代曾用硝土(含有Ca(NO 3) 2、少量NaCl等)和草木灰(含有K 2CO 3)作原料制取KNO 3.某化学兴趣小组设计了如图实验流程:
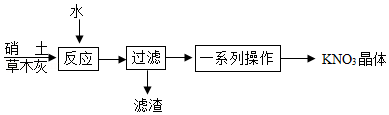
①"反应"过程中的化学方程式为 。
②"过滤"操作必须用到的玻璃仪器有烧杯、玻璃棒和 。
③如图是硝酸钾和氯化钠的溶解度曲线。"一系列操作"包括"加热蒸发浓缩、再冷却到一定温度、过滤"等步骤。其中"冷却到一定温度"能获得纯度较高的硝酸钾晶体的原因是 。
(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C 3H 5O 9N 3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为 。
合成硝化甘油的化学方程式为C 3H 8O 3+3HNO 3═C 3H 5O 9N 3+3H 2O.现用46kg甘油(C 3H 8O 3)和足量硝酸反应,理论上能生成多少硝化甘油?(写出计算过程)
已知:向饱和食盐水中通入氨气得到饱和铵盐水,饱和铵盐水能与CO2发生反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如图:
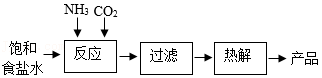
(1)常温时,饱和铵盐水的pH (填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是 。
(2)过滤时,若经两次过滤滤液仍浑浊其原因可能是 (任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为 。
镁及其合金是一种用途广泛的金属材料,大量的金属镁是从海水或卤水中提取的,其主要步骤见如图:
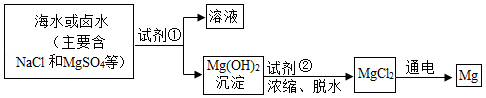
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 ;
(2)加入试剂①后,分离得到Mg(OH)2沉淀的方法是 ;
(3)试剂②可以选用 ;
(4)通电后,MgCl2分解生成Mg和Cl2的化学反应方程式 。
镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水蒸发结晶得到粗盐后的苦卤水中提取的。根据下列工业制镁的主要生产步骤回答问题:
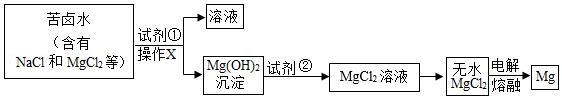
(1)操作X的名称是 ;
(2)试剂②可选用 ;
(3)MgCl2在熔融状态下,通电后会产生金属镁和氯气(Cl2),该反应的化学方程式为 。