碳酸亚铁(FeCO3)是制取补血剂的原料,以下是用黄铜矿废液[溶质成份为Fe2(SO4)3、CuSO4及H2SO4]为原料,制备碳酸亚铁并回收铜的生产流程示意图:
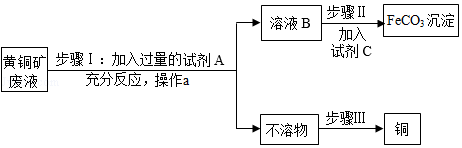
已知:①Fe与Fe2(SO4)3溶液能发生反应生成FeSO4②溶液B中只有一种溶质
(1)步骤1中,试剂A为 ,加入过量A的目的是 ;反应过程中观察到的现象之一是有红色固体析出,写出该反应的化学方程式 。
(2)操作a的名称: 。
(3)步骤Ⅱ中,试剂C的化学式可能为 。
(4)步骤Ⅲ的目的是:除去“不溶物”中的另一种金属,回收得到纯净、干燥的铜。用化学方法回收铜的操作步骤为:加入过量的 、过滤、 、干燥;回收铜的物理方法为 。
建造“辽宁”舰需要大量的金属钛,钛因其密度小,熔点高、常温下酸碱,耐腐蚀等优良性能,被誉为“未来金属”。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其主要工艺流程如下图所示:
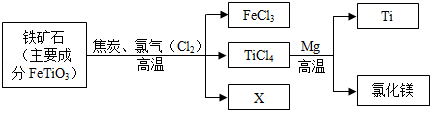
请写出上述工艺流程中镁在高温下与TiCl4反应生成Ti和氯化镁的化学方程式 。其基本反应类型是 。图中X是一种极易与人体血液中血红蛋白结合的有毒气体,该气体的化学式为 。
过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3为原料制备CaO2的一种工艺流程如图1:

[查阅资料]
Ⅰ.Ca(OH)2+2NH4Cl=CaCl2+2NH3•H2O
Ⅱ.CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4Cl
Ⅲ.CaO2•8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是 ;Ca(OH)2的俗名为 ;“过滤1”所得滤渣的主要成分是 。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、 。生产过程中为了精确测定溶液的pH,常使用 (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2•8H2O的反应时间(t)对其产率(w)的影响如图2所示。
①平均反应速率最快的时间段为: (填字母)。
a.0~10min b.10~20min c.20~30min d.30~40min
②30min后,w开始下降的主要原因是 。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%) 。
某化学活动小组在实验室以MnO2固体为原料制取少量MnCO3,基本流程如下:
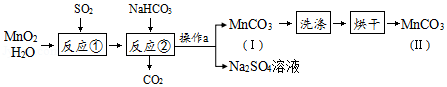
已知:MnSO4与MnCl2都可溶于水;MnCO3难溶于水且在100℃时开始分解。
(1)反应①为化合反应,产物为MnSO4.该反应的化学方程式为 ,下列物质中不能与MnSO4反应的有 。
A.稀硫酸 B.BaCl2 C.盐酸 D.Na2CO3
(2)操作a要用到的实验用品中,除玻璃仪器外,还有 (填具体的实验用品)。
(3)产品MnCO3(Ⅱ) 比MnCO3(Ⅰ) 更纯净,原因是产品MnCO3(Ⅰ) 经过洗涤、烘干以后,表面附着的H2O及 (填化学式)等杂质已被除去。
(4)为了获得纯净的MnCO3,烘干时需要控制的条件是 。
2018年5月23日至25日,第九届中国卫星导航年会在哈尔滨拉开帷幕,中海达、华大北斗等一批国内企业先后发布了自主研发的北斗芯片产品。芯片的主要成分是硅,如图是工业上以石英砂(SiO2)为主要原料制取纯硅的种方法,请回答以下问题。
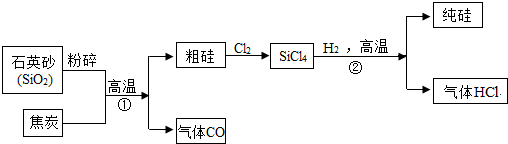
(1)地壳中硅元素的含量仅次于 元素;
(2)写出反应①的化学方程 ;
(3)反应②的基本反应类型是 ;
(4)尾气氯化氢必须收集处理,不能排放到空气中,请简要说明原因 。
结构观、微粒观、元素观和转化观都是化学学科的基本观念。
(1)将“宏观﹣微观﹣符号”表征相结合是化学学科独特的思维方式。科学家最近在﹣100℃合成了一种化合物,其分子模型如图所示。该物质的化学式是 ;从物质结构的观点说明该物质具有可燃性的原因是 ,该物质在空气中完全燃烧的化学反应方程式为 。
(2)在制备物质时,根据所制物质的组成成分选择原料,要考虑原料中能否提供产品所需的成分,且能够转化到产品中。如利用海水中的NaCl制纯碱(Na2CO3)的过程中,NaCl只提供了Na2CO3所需的“Na”,则还需要能提供含有 元素的物质。按此思路,若用Na2CO3制取NaOH,需要用到生活中一种常见的廉价原料是 (填俗称)。
(3)已知由Cu到Cu(OH)2可经三步转化:Cu→CuO→CuSO4→Cu(OH)2,而Fe经两步反应得到Fe(OH)2,请补全转化的过程:Fe→ →Fe(OH)2。

CaCl2应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产CaCl2的流程如下:

(1)氧化铁和盐酸反应的化学方程式为 。
(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(3)滤液1中的溶质有HCl、FeCl3、MgSO4和 。
(4)写出滤液1中加入BaCl2发生的化学反应方程式 。
(5)滤液2中加入Ca(OH)2可以除去HCl、MgCl2和 。
(6)滤液3呈碱性,为使溶液pH降低,可加入适量的 。
老师要求用规定量的BaCl2溶液与适量的Na2SO4溶液制备BaSO4.完成操作I后,丁丁发现自己错把Na2CO3溶液当成Na2SO4溶液,而此时BaCl2溶液已完全消耗。老师启发他,可用生成物和其他试剂完成制备BaSO4的实验。整个实验流程如图所示:
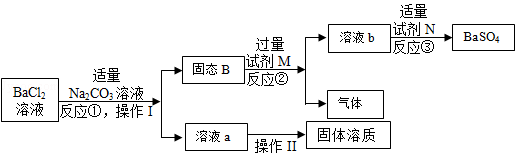
(1)反应②的化学方程式为 ,溶液b中的溶质有 。
(2)反应③的基本反应类型为 。
(3)操作Ⅱ的名称为 。
(4)从理论上讲,该实验过程最终得到的BaSO4质量与原方案得到的BaSO4质量是否相等? (填“是”或“否”)
某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
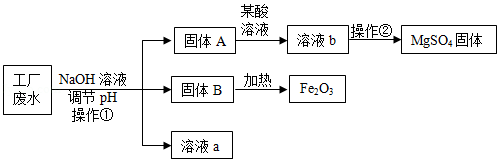
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
在牙膏中常用轻质碳酸钙粉末作摩擦剂.小李在实验室以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠.

(1)操作②的名称是 .
(2)该流程中有两个反应,产物中均出现碳酸钙,这两个反应的化学方程式分别为 .
(3)为验证加入Na2CO3溶液后,溶液M中的溶质是否反应完全,可取上层清液加入 (填序号)进行检验.
A.碳酸钠溶液 B.铁粉 C.无色酚酞.
常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得.

(1)实验室用KClO3制取氧气的化学方程式为 .
(2)反应Ⅰ中,通电时发生的反应方程式为NaCl+3X NaClO3+3H2↑,则X的化学式为 .
(3)反应Ⅱ的基本反应类型为 .
(4)该转化中可以循环利用的物质是 (填名称).
碲(Te)广泛用于彩色玻璃和陶瓷工艺。用某工业废渣(主要含有TeO2、少量Ag、Au)为原料制备碲的一种工艺流程如图:
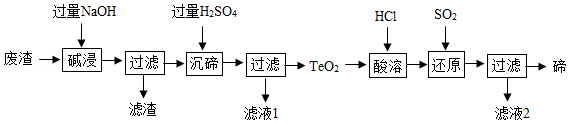
回答下列问题:
(1)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式 。
(2)滤液1中的两种溶质是H2SO4和 (填化学式)。
(3)上述工艺流程中设计“废渣→…→TeO2”的目的是 。
(4)“酸溶”后,在TeCl4溶液中通入SO2,反应生成碲和初中化学中两种常见的酸,则该反应的化学方程式是 。
金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成份为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
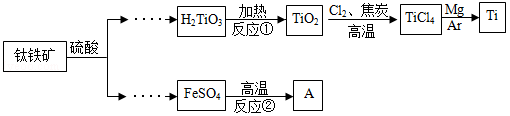
(1)反应①的化学方程式为 。
(2)TiO2与焦炭(C)和Cl2在高温下反应,该反应中C和Cl2按质量比为12:71的比例参加反应,相应的化学方程式为 。
(3)反应②的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体。则该反应的化学方程式为 。
我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热到约800℃,得到黄铜(铜锌合金,外观似黄金),其流程如下:
请回答下列问题:
(1)赤铜矿中铜元素的化合价为 ;
(2)区分黄铜与黄金,可用酒精灯灼烧,若看到 ,则是黄铜;若表面无现象,则是黄金;
(3)气体A中除CO2外,还有一种气体是 (填化学式);
(4)加热时,发生反应的化学方程式有:①ZnCO3═ZnO+CO2↑
②C+2ZnO═2Zn+CO2↑ ③ ;(木炭粉与赤铜的反应)
已知化学反应中,物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫做还原反应。在反应②中,ZnO发生 (填“氧化”或“还原”)反应;
