我国著名的化学家侯德榜发明了制纯碱的方法被称为侯氏制碱法,其部分流程如图所示:

(1)NH3中氮元素的化合价为 价;
(2)通入CO2发生反应的化学方程式为NH3+CO2+NaCl+X═NaHCO3↓+NH4Cl,其中X的化学式为 ;
(3)在制纯碱过程中得到的NH4Cl常用来作化肥,该化肥属于 ;
A.氮肥
B.磷肥
C.钾肥
D.复合肥
(4)将制得的碳酸氢钠固体加热分解,生成纯碱,二氧化碳和水,写出该反应的化学方程式 。
下列我国著名科学家中,主要贡献为发明了联合制碱法的是( )
A.袁隆平B.侯德榜C.张青莲D.屠呦呦
侯德榜研创的联合制碱法生产的“碱”是( )
A.NaClB.NaHCO3C.Na2CO3D.NaOH
"NaCl+CO 2+NH 3+H 2O═NaHCO 3+NH 4Cl"是著名的"侯氏制碱法"的重要反应,下列有关叙述正确的是( )
| A. |
NaHCO 3是纯碱 |
| B. |
析出晶体后剩余溶液中溶质只有NH 4Cl |
| C. |
配制饱和食盐水时,可通过搅拌来提高食盐的溶解度 |
| D. |
向饱和食盐水中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收 |
我国制碱工业先驱侯德榜先生发明了将制碱与制氨结合起来的联合制碱法,大大提高了原料利用率.其模拟流程如下:

(1)反应 ①的化学方程式是 .
(2)反应 ②的化学方程式是 .
(3)操作a的名称是 .
(4)NH 4Cl可用作农业生产的氮肥,铵态氮肥常用 检验.
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
NH4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 ,可向滤出晶体后的NaHCO3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
(3)图中,A是60℃时含有120g水的NH4Cl溶液,经过如下操作后,得到固体。

I.C中溶液的质量是 g.A溶液为NH4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
③由B到C开始析出NH4Cl固体的温度在40℃至50℃之间。
对于下列生产、生活中的反应,人们希望加快其反应过程的是( )
A.食物腐败B.铁生锈C.工业制纯碱D.酸雨形成
我国科学家侯德榜先生以饱和食盐水、NH3和CO2为原料,发明了“联合制碱法”。该方法中涉及的反应有:
①NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
②2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
下列说法不正确的是( )
A.氯化钠由钠离子和氯离子构成
B.碳酸氢钠可用于治疗胃酸过多
C.该生产工艺中CO2可以循环利用
D.副产品氯化铵作氮肥时,应与碱性物质混合施用
化学让我们的生活更美好,科学家为此作出了很大的努力,其中在制碱工业作出巨大贡献的是( )
A.拉瓦锡B.门捷列夫C.汤姆生D.侯德榜
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
实验 |
A+B |
A+C |
A+D |
B+C |
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
①写出溶液B、C中溶质的化学式:B ,C 。
②写出溶液A与D反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X;
2NaHCO3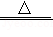 Na2CO3+H2O+CO2↑等。
Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为 。
②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为 (写最简比)。
教材中的插图不仅使教材美观,还能图文并茂地提供信息。下列说法正确的是( )
①海水制碱流程﹣﹣直观呈现氨碱法制纯碱的过程
②地壳中的元素分布﹣﹣地壳中各元素的地理分布
③健康饮食金字塔﹣﹣指导人们科学膳食、合理营养
④空气质量级别﹣﹣空气质量级别数值越大污染指数越小
A.①③B.①②C.②③D.①④
我国科学家侯德榜在氨碱法的基础上创立了更为先进的联合制碱法(候氏制碱法),其生产流程简明如下:

请读识流程图并回答下面问题:
(1)写出沉淀池中发生反应的化学方程式 ;
(2)上述流程中气体X的化学式是 ;
(3)沉淀池中晶体转移至焙烧炉时用到操作①,操作①的名称是 。
1926年的"联合制碱法"改进了国外的纯碱生产工艺,主要流程如图所示:

(1)它是由我国著名化学家 创立的.
(2)如何取出从沉淀池中不断结晶析出的碳酸氢钠: (填操作名称);碳酸氢钠在生产生活中的用途: (写出一种即可).
(3)它使原料氯化钠的利用率从70%提高到96%,主要是因为设计了 (填流程图中的编号)的循环.
我国制碱工业先驱侯德榜先生发明了将制碱与制氨结合起来的联合制碱法,大大提高了原料利用率.其模拟流程如下:

(1)反应 ①的化学方程式是 .
(2)反应 ②的化学方程式是 .
(3)操作a的名称是 .
4Cl可用作农业生产的氮肥,铵态氮肥常用 检验.
我国著名化工专家侯德榜创立了"候氏制碱法",促进了我国民族工业的发展。其生产原理是在氯化钠饱和溶液中通入氨气,再通入二氧化碳,使溶解度较小的碳酸氢钠从溶液中以沉淀的形式析出:
NaCl+NH 3+CO 2+H 2O═NH 4Cl+NaHCO 3↓
过滤出碳酸钠晶体,再受热分解得到产品:2NaHCO 3  Na 2CO 3+H 2O+CO 2↑
Na 2CO 3+H 2O+CO 2↑
(1)"侯氏制碱法"制得的"碱"是 (写化学式);
(2)根据化学方程式计算,5.85吨NaCl可制得8.4吨NaHCO 3,实际上从反应后的混合物溶液中析出NaHCO 3晶体的质量 8.4吨;(选填"大于"、"等于"或"小于")
(3)与"侯氏制碱法"不同的是,比利时科学家苏尔维在制碱过程中,向滤出NaHCO 3晶体后的混合溶液中加熟石灰以回收氨气:2NH 4Cl+Ca(OH) 2  CaCl 2+2NH 3↑+2H 2O
CaCl 2+2NH 3↑+2H 2O
请计算:NH 4Cl质量分数为20%的混合溶液5.35吨,完全反应后理论上可获得NH 3多少吨?