写出下列反应的文字表达式,并用题前的序号填空.
硫在空气中燃烧 ;
木炭在氧气中燃烧 ;
氯酸钾与二氧化锰混合制取氧气 .
以上各反应属于化合反应的是 ,属于氧化反应的是 ,属于分解反应的是 .
下列变化能用质量守恒定律解释的是
| A.纸张撕碎之后总质量不变 |
| B.100g酒精与100g水混合后总质量为200g |
| C.100ml酒精与100ml水混合后总体积小于200ml |
| D.石灰石高温煅烧一段时间后,各生成无知量之和与原固体质量不相等 |
下列各图所示变化属于化学变化的是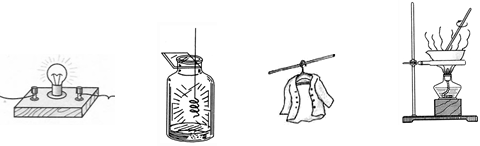
| A.灯泡通电发光 | B.铁丝在氧气中燃烧 | C.湿衣晾干 | D.食盐水的蒸发 |
(1)用氯酸钠(NaClO3)和盐酸反应可制得二氧化氯,反应方程式:
2 NaClO3+ 4HCl = 2 ClO2↑+ Cl2↑ + 2X + 2 NaCl ,请推断出X的化学式为
(2)汽车尾气(含有CO,SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个“催化转换器”,其特点是使CO和NO反应,生成一种空气中含量最多的气体,另一种可参与植物光合作用的气体。写出CO与NO反应的化学方程式是___ ____ 。
(3)自来水消毒过程中通常会发生如下化学反应,其反应的微观过程可用下图表示:

①请写出甲图所示反应的化学方程式 ;
②乙图所示反应的基本反应类型为 ;
③你能总结出的一条结论是 。
(4)实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制二氧化硫气体。二氧化硫气体是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成亚硫酸(H2SO3)。
①试写出实验室制取二氧化硫气体的化学方程式:_______________(与碳酸钙与盐酸的化学反应相似)
②制取二氧化硫时,发生装置应选用下图所示的 装置(填代号,下同);收集二氧化硫气体时,应选用下图所示 的装置。

(5)称取12.5 g石灰石(主要成分是CaCO3,杂质不参加反应)放人烧杯中,向其中加入50 g稀盐酸,二者恰好完全反应。反应结束后称量 烧杯中剩余物质的总质量为58.1 g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中CaCO3的质量分数
某化合物4.6g完全燃烧,生成8.8g二氧化碳和5.4g水,该化合物中
| A.只含碳、氢两种元素 | B.只含碳、氧两种元素 |
| C.含有碳、氢、氧三种元素 | D.无法确定 |
下列现象中,属于化学变化的是
| A.冰受热融化成水 | B.铁在潮湿空气中生锈 |
| C.电灯通电后发光、发热 | D.潮湿的衣服经太阳晒,变干了 |
某物质在氧气中燃烧后,产物只有水和二氧化碳,则该物质的组成中
A.一定只含C、H元素
B.一定含C、H元素,可能含O元素
C.一定含C,可能含H
D.一定含C、H、O元素
初中化学学习中,我们初步认识了物质的微观结构。
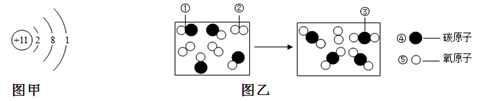
(1)氯化钠、金刚石、干冰三种物质中,由离子构成的物质是 。
(2)图甲是某粒子的结构示意图,该粒子在化学反应中容易 电子(填“得到”或“失去”)。
(3)图乙是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是 (填序号)。
| A.①② | B.②③ | C.③④ | D.④⑤ |
草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解。小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如图所示。请回答下列问题:

(1)t1~t2时问段内固体质量减少的原因是产生了一种极易与血红蛋白结合的有毒气体,该气体的化学式为 ;同时生成一种白色同体,它与大理石的主要成分相同,则该段时问内反应的化学方程式为
(2)t2~t3时间段内固体质量不变的原因是
(3)t3~t4时间段内反应的化学方程式为
写出下列反应的化学方程式并注明类型
(1)碳不充分燃烧 ( )类型
(2)碳高温还原氧化铁
(3)将氨气(NH3)通入氧化铜中加热,生成了铜、水和一种单质气体________________
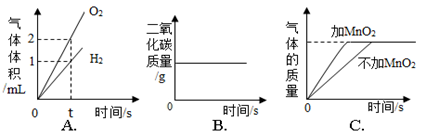
下列图像能正确反映对应的变化关系的是
 D.
D.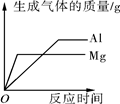
A.电解水生成两种气体的体积
B.木炭在密闭的容器内燃烧
C.用等质量过氧化氢溶液制取氧气
D.将等质量的镁片和铝片分别加入过量的等溶质质量分数的稀盐酸中
在反应4Zn+10HNO3═4Zn(NO3)2+X+3H2O中,X的化学式为
| A.NH3 | B.NH4NO3 | C.NO | D.NO2 |
日常生活中见到下列现象,其中发生了化学变化的是
| A.冬天的早晨,玻璃窗上出现美丽的雪花 | B.自行车轮胎在烈日下爆裂 |
| C.牛奶放置时间过长结块 | D.玻璃杯打碎 |
MCO3广泛应用于建筑工业。
(1)某碳酸盐样品MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(友情提醒:①MCO3 ==MO+CO2↑②,不考虑植物油中溶解CO2产生的影响)。③不考虑装置中的空气对实验的影响

①连接装置并___________;②准确称量样品的质量10g;③装药品,_________________,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
Ⅰ.请将上述实验步骤补充完整①________________;③_________________
Ⅱ.B装置量气管上方少量植物油的作用是 ___________;
Ⅲ.步骤⑥中调节液面相平的操作是将水准管____________(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若其他操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是 ___________(填字母序号);
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)某研究小组使用上述装置测定M的相对原子质 量,测得3组数据如下表所示。取3组数据的值(这样做的目的是为了减少实验误差)得到CO2的体积为 __________L。又知常温常压下CO2的密度为1.964 g/L,则生成CO2的质量约是____________g(结果保留一位小数),据此计算M的相对原子质量的值。(写出计算M相对原子质量的过程)。
| 组别 |
样品质量 |
CO2体积 |
| 第1组 |
10 g |
2.239 L |
| 第2组 |
10 g |
2.241 L |
| 第3组 |
10 g |
2.240 L |