化学实验是科学探究的重要途径。请根据下列实验图示回答相关问题: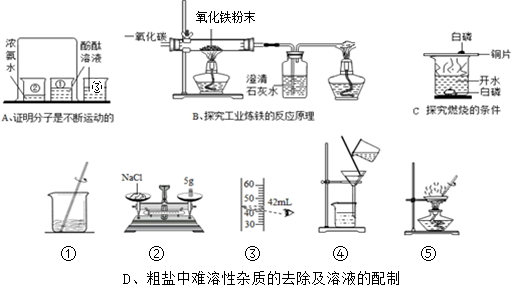
(1)A实验中,烧杯③的作用分别是 。
(2)B实验中,硬质玻璃管中的现象是 ;装置末端酒精灯的作用是 。
(3)实验C中探究出的结论是 。
(4)D实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 (填序号),步骤⑤中玻璃棒的作用是 ;若按照②③①的步骤配制50g l6%的氯化钠溶液,所配制溶液的溶质质量分数 (填“偏小”或“偏大”)。
2015年3月22日是第二十三届“世界水日”,主题是“水与可持续发展”。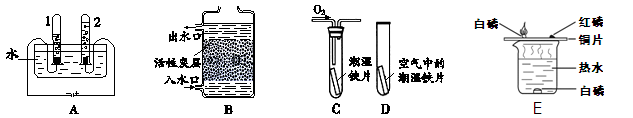
(1)根据下图回答问题。
①A图所示的是水的电解实验,试管2中收集的气体是 (填名称)。
②B图所示的是活性炭净水器的示意图,其中活性炭的作用是 。
③C、D图所示的是探究铁生锈条件的实验,一段时间后发现C中铁片变红,D中铁片依然光亮,对比C、D中的现象,说明决定铁生锈快慢的一个重要因素是: 。
④E图所示的是探究燃烧条件实验,其中热水作用 。
(2)若用质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3)配制110g质量分数为5%的氢氧化钠溶液。
①计算:需10%的氢氧化钠溶液体积为 mL。
②量取:用量筒量取氢氧化钠溶液和水,均倒入烧杯中。若量取氢氧化钠溶液读数时俯视,而其余操作均正确,这样配得的溶液的溶质质量分数会 (填“偏高”、“偏低”或“无影响”);用量筒量取水。
③混匀:用玻璃棒搅拌,使氢氧化钠溶液和水混合均匀。
④装瓶并贴上标签。
(3)某化学兴趣小组为了测定某工厂废水中硫酸的质量分数,取100g废水于烧杯中,加入上述配制好的氢氧化钠溶液80g,恰好完全反应(废水中无不溶物,其它成份不与氢氧化钠反应)。请计算废水中硫酸的质量分数。(写出计算过程)
金属材料在人类的生产、生活中有着十分重要的作用。
(1)多种金属可以压成薄片,抽成细丝,说明金属具有 性。
(2)实验室有打磨过的铝片、铁片和硫酸铜溶液。兴趣小组同学欲验证铝、铁和铜的活泼性顺序,进行如下操作:
①取少量硫酸铜溶液于试管A中,将铁片(足量)插入硫酸铜溶液中,充分反应后将铁片取出,观察到的实验现象是 。
② (请补充实验具体操作)。
③取少量硫酸铜溶液于试管B中,将铝片插入硫酸铜溶液中,充分反应,写出该反应的化学方程式 。
结论:三种金属的活泼性由强到弱顺序是 。
(3)金属腐蚀造成的损失巨大,对金属腐蚀的控制尤为重要。下列对金属的防护措施不合理的是 (填序号)。
a、齿轮表面涂油 b、将钢材深埋保存
c、将钢刀浸泡在盐水中 d、车圈镀铬。
铁是生活中常用的金属。
(1)生活中常使用铁锅炒菜,这是利用了金属的 性。
(2)铁制品容易生锈,铁生锈的条件是 。
如图为"一氧化碳与氧化铁反应"的实验装置.该反应利用
的还原性,将
中的铁还原出来。

(1)写出高温条件下
与
反应的化学方程式。
(2)实验过程中,常在装置图末端的导管口放一盏燃着的酒精灯(灯焰处于导管口),这样做的目的是。
(3)通过B装置可检验A中的生成物含有
,该反应的化学方程式为。
(4)在此实验中,我们还认识到
和
的化学性质有许多的不同。
①请写出其中的一点。
②试从微观的角度分析
和
化学性质不同的原因是。
化学实验要严格按操作要求进行,操作不当造成失败,实验现象准确获得成功,回答问题:
(1)在A中将尾气经过导管通入到酒精灯火焰上的一条优点是 __。
(2)B实验操作造成的后果是 。
(3)在C 实验中,判断稀盐酸与氢氧化钠恰好完全反应现象是 。
金属材料在生产生活中应用十分广泛。
(1)根据下图金属应用实例推断,金属具有的物理性质 (答一点)。
(2)每年因锈蚀而浪费掉的金属材料是金属年产量的20%左右。自行车架子防锈的方法是 。
(3)金属资源有限不可再生。保护金属资源除了防锈外还有 (答一条)。
化学源于生活,服务于生活.请从化学的角度回答下列问题:
(1)炒菜时油锅中的油不慎着火,可用锅盖盖灭.其灭火的原理是。
(2)长期饮用硬水对人体健康不利.为了检验某水样是硬水还是软水,可往水样中加入.生活中常用方法降低水的硬度。
(3)铁在空气中锈蚀,实际上是铁跟氧气、水等物质作用,发生一系列复杂的化学反应.请例举一种防止铁制栏杆生锈的措施。
(9分)铜和铁是生产、生活中广泛使用的金属。
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为________________。
(2)铁生锈的条件是__________;铜表面也容易生成绿色铜锈,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3.其组成元素有__________种。
(3)老师用生锈的铜片、铁片和稀硫酸进行实验.实验过程如下图所示(部分生成物已略去)。
①紫红色固体C化学式为__________;
②写出II中反应的化学方程式________________________________________
人类的生产生活离不开金属。
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
(2)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人。铁生锈的主要原因是 。自行车是很多人出行的工具,写出一条防止自行车钢圈生锈的措施_________。
金属与人类的生产和生活密切相关
(1)材料:我国第四套人民币中的一元硬币是钢芯镀镍(Ni)合金,五角硬币为钢芯镀铜合金,一角硬币为铝合金或不锈钢,请回答:
①铸造硬币用到的材料是 (填"合成材料"或"金属材料")。
②用于铸造硬币的金属,应该具有的性能有 (填字母序号)。
A.耐磨B.光泽好C.导热性好D.易加工
③常温下,铝具有很好的抗腐蚀性,是因为 。
(2)下列做法中,有利于保护金属资源的是 (填字母序号)。
A.回收利用废旧金属制品B.任意开采铁矿石C.开发金属代用品
(3)金属元素与身体健康有密切关系。某些元素摄入不足,会引发病症。如:缺铁会引起 ;缺少 元素会引起佝偻病。
兰州市中山桥南侧的"将军柱"(铸造材质主要是铁),距今已有630年的历史,它与中山桥一起组成了"兰州铁路"一景,近日"将军柱"商标获得国家批准.

(1)"将军柱"表面已出现较多锈迹,其主要原因是铁与等物质共同作用的结果,生活中常用稀硫酸除去铁制品表面的铁锈,其反应的化学方程式为;
(2)废旧金属的回收利用是保护金属资源的重要途径,请你再写出一条保护和节约金属资源的有效方法或途径:。
如图是学生经常使用的交通工具:自行车,请完成下列各题:
(1)由金属材料制成的有 (选一种物质填序号),属于合成材料的是 (选一种物质填序号)。
(2)车轮的钢圈在潮湿的空气中会生锈,生锈实质上是铁与空气中的水和 发生了缓慢氧化而造成的;用稀硫酸除铁锈(Fe2O3)的原理: (用化学方程式表示)。
(3)利用铁生锈的原理在食品工业上还有应用。如“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,它能够吸收空气中的水分和氧气,若用化学方法检验使用一段时间后的“双吸剂”是否完全失效,写出检验方法 。
竖炉冶铁工艺流程如下图所示。
回答下列问题:
(1)该工艺流程中,甲烷的作用是 。
(2)用化学方程式表示还原反应室内炼铁的原理 。
(3)该工艺流程中,可循环利用的物质是 。
化学就在我们身边.请你按要求回答下列问题:
(1)将50
酒精和50
水混合,得到溶液的体积小于100
.试从微观的角度解释这一宏观现象:。
(2)在农村广泛使用沼气(主要成分是
),既可以改善人居环境,又使废弃物得到充分利用。请写出沼气充分燃烧的化学方程式:;
(3)在焊接钢管时,工人师傅通常用稀盐酸先将其表面的铁锈除去,反应的化学方程式是:。