(4分)生活中有许多铜制品,如:铜暖手炉、铜雕塑、铜芯线、铜工艺品等等。
(1)其中作铜芯线是利用了铜的 (物理性质) 。
(2)东汉晚期的青铜奔马(马踏飞燕)是我国的旅游标志,但由于时间过长已经满身“绿锈”。和铁生锈类似,铜在空气中被腐蚀生成了绿色的碱式碳酸铜 ,根据它的组成判断,可能是铜和空气中的 、 、 (填化学式)共同发生了化学反应。
,根据它的组成判断,可能是铜和空气中的 、 、 (填化学式)共同发生了化学反应。
(3)孔雀石是一种主要含有绿色碱式碳酸铜的矿石。人们发现:森林火灾后,孔雀石表明往往有红色物质出现。提示:Cu2(OH)2CO3===2CuO+H2O+CO2↑试写出产生红色物质的其中一个化学方程式 。
(4)碱式碳酸铜又可以表示为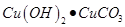 ,取少量碱式碳酸铜溶于适量稀盐酸中,得到蓝色的溶液,其溶质为 (填化学式)。
,取少量碱式碳酸铜溶于适量稀盐酸中,得到蓝色的溶液,其溶质为 (填化学式)。
应用广泛的金属。没有金属,生活是难以想象的。请你根据所学知识回答下列问题:
(1)某炼铁厂常以焦炭、赤铁矿、空气等为主要原料炼铁,反应过程如下图所示。
其中焦炭的作用是__________,写出碳与二氧化碳反应的化学方程式 。
(2)生产钛(Ti)的部分工艺流程图如下:
写出镁与四氯化钛(TiCl4)发生反应的化学方程式 ;该反应属于 反应(填基本反应类型名称)。上述反应需在氩气环境中进行,理由是 。
(3)将一定量的锌加入到稀硫酸、硫酸亚铁和硫酸铜的混合溶液中,反应停止后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,有气泡产生。则滤渣中一定含有 (填化学式),滤液中一定含有的溶质是 (填化学式)。
(4)一定质量含杂质的铁(杂质不溶于水,也不参与反应)与100 g16%硫酸铜溶液恰好完全反应,过滤得到干燥的固体6.8 g,则含杂质的铁中的铁的质量分数是 (计算结果保留至0.1%)。
某种氧化铜样品中混有少量木炭粉,为测定该样品中氧化铜的质量分数,某同学设计了如下装置进行实验(N2不参加反应,不考虑外界空气对实验的影响)。
①该实验需要测定的量:反应前后装置Ⅱ的质量和 (9) 的质量
②充分反应后,装置Ⅱ的质量增加了0.44 g,则生成的二氧化碳的物质的量是 (10) mol。求参加反应的氢氧化钠的物质的量。(请根据化学方程式列式计算) (11)
③为达到实验目的,对反应前氢氧化钠溶液中溶质质量的要求是 (12) g。
④关于该实验的下列说法正确的是(13) 。
| A.当黑色粉末全部变为光亮红色时方可停止加热 |
| B.实验结束时先熄灭酒精喷灯会导致Ⅱ中液体倒流入Ⅰ中 |
| C.只称量反应前后装置Ⅰ中固体质量也可达到实验目的 |
| D.用氧气代替氮气完成实验也可达到实验目的 |
归纳整理是学习的重要方法,框图整理是一种简单明了的整理方法。
㈠小琴同学归纳了有关二氧化碳的转化知识关系图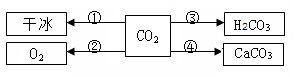
(1)上图中①、②、③、④变化中属物理变化的一种是 (填序号);
(2)上图物质中属于氧化物的是: ;
(3)图中变化②可由自然界中最要的变化之一来实现,该过程是植物的 作用;
(4)写出实现变化④的反应化学方程式 。
㈡下图是小燕同学归纳的有关铁的转化知识关系图:
(1)小燕认为,转化①是铁生锈,请写出防止铁生锈蚀的一种措施 。
(2)反应②的化学方程式: 。
(3)小林欲通过加入稀硫酸或硫酸铜溶液来实现反应③,请你帮他写出其中的一个反应的化学方程式: 。
(8分)以下是初中化学的一些基本实验: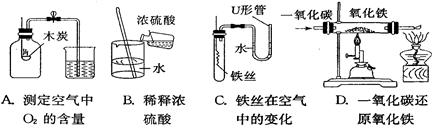
①上述实验中不能达到实验目的的是_______(填字母)。
②A中盛放木炭的仪器名称是_ _;B中玻璃棒的作用是___ __;
一段时间后,C中的实验现象为__ ___;
D中硬质玻璃管内发生反应的化学方程式为__ ___,
酒精灯的作用是_ 。
2014年央视《质量报告》,某品牌汽车车身漆面鼓包,钢板锈蚀严重。工作人员承认没有使用镀锌板,且存在设计缺陷导致积水生锈。采用镀锌钢板是为了 ;铁生锈时会有如下反应发生:4Fe+3O2+6H2O =4X,其中X的化学式为 ;工业上可用赤铁矿来炼铁,请写出反应的化学方程式为 。
汽车是现代生活中不可缺少的交通工具。
(1)下列汽车部件所用的主要材料属于合金的是 (填字母序号)。
A. 橡胶轮胎 B. 钢板车门 C. 玻璃风挡
(2)对汽车的部分钢铁部件进行喷漆可以防止其生锈,原因是 。
(3)汽车制造需要消耗大量的钢铁。工业炼铁时,CO和赤铁矿(主要成分是Fe2O3)发生的主要反应的化学方程式为 。
(4)目前,CNG双燃料环保汽车已经投入使用,这种汽车所用的燃料是汽油和压缩天然气。天然气的主要成分燃烧的化学方程式为 。
下列是初中化学中的一些重要实验,请回答:
(1)甲中红磷必须足量的原因是 。
(2)乙中玻璃管内反应的化学方程式是 。
(3)丙实验中两种物质恰好完全反应,依据质量守恒定律,反应前稀盐酸和碳酸钠粉末的质量总和等于反应后的 质量总和;
化学实验是科学探究的重要途径。请根据下列实验图示回答相关问题: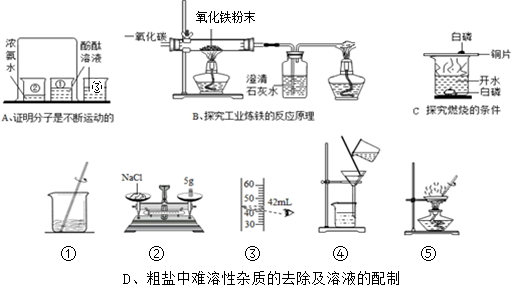
(1)A实验中,烧杯③的作用分别是 。
(2)B实验中,硬质玻璃管中的现象是 ;装置末端酒精灯的作用是 。
(3)实验C中探究出的结论是 。
(4)D实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 (填序号),步骤⑤中玻璃棒的作用是 ;若按照②③①的步骤配制50g l6%的氯化钠溶液,所配制溶液的溶质质量分数 (填“偏小”或“偏大”)。
2015年3月22日是第二十三届“世界水日”,主题是“水与可持续发展”。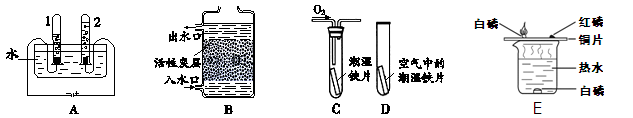
(1)根据下图回答问题。
①A图所示的是水的电解实验,试管2中收集的气体是 (填名称)。
②B图所示的是活性炭净水器的示意图,其中活性炭的作用是 。
③C、D图所示的是探究铁生锈条件的实验,一段时间后发现C中铁片变红,D中铁片依然光亮,对比C、D中的现象,说明决定铁生锈快慢的一个重要因素是: 。
④E图所示的是探究燃烧条件实验,其中热水作用 。
(2)若用质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3)配制110g质量分数为5%的氢氧化钠溶液。
①计算:需10%的氢氧化钠溶液体积为 mL。
②量取:用量筒量取氢氧化钠溶液和水,均倒入烧杯中。若量取氢氧化钠溶液读数时俯视,而其余操作均正确,这样配得的溶液的溶质质量分数会 (填“偏高”、“偏低”或“无影响”);用量筒量取水。
③混匀:用玻璃棒搅拌,使氢氧化钠溶液和水混合均匀。
④装瓶并贴上标签。
(3)某化学兴趣小组为了测定某工厂废水中硫酸的质量分数,取100g废水于烧杯中,加入上述配制好的氢氧化钠溶液80g,恰好完全反应(废水中无不溶物,其它成份不与氢氧化钠反应)。请计算废水中硫酸的质量分数。(写出计算过程)
化学实验要严格按操作要求进行,操作不当造成失败,实验现象准确获得成功,回答问题:
(1)在A中将尾气经过导管通入到酒精灯火焰上的一条优点是 __。
(2)B实验操作造成的后果是 。
(3)在C 实验中,判断稀盐酸与氢氧化钠恰好完全反应现象是 。
金属材料在生产生活中应用十分广泛。
(1)根据下图金属应用实例推断,金属具有的物理性质 (答一点)。
(2)每年因锈蚀而浪费掉的金属材料是金属年产量的20%左右。自行车架子防锈的方法是 。
(3)金属资源有限不可再生。保护金属资源除了防锈外还有 (答一条)。
(9分)铜和铁是生产、生活中广泛使用的金属。
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为________________。
(2)铁生锈的条件是__________;铜表面也容易生成绿色铜锈,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3.其组成元素有__________种。
(3)老师用生锈的铜片、铁片和稀硫酸进行实验.实验过程如下图所示(部分生成物已略去)。
①紫红色固体C化学式为__________;
②写出II中反应的化学方程式________________________________________
人类的生产生活离不开金属。
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
(2)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人。铁生锈的主要原因是 。自行车是很多人出行的工具,写出一条防止自行车钢圈生锈的措施_________。
如图是学生经常使用的交通工具:自行车,请完成下列各题:
(1)由金属材料制成的有 (选一种物质填序号),属于合成材料的是 (选一种物质填序号)。
(2)车轮的钢圈在潮湿的空气中会生锈,生锈实质上是铁与空气中的水和 发生了缓慢氧化而造成的;用稀硫酸除铁锈(Fe2O3)的原理: (用化学方程式表示)。
(3)利用铁生锈的原理在食品工业上还有应用。如“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,它能够吸收空气中的水分和氧气,若用化学方法检验使用一段时间后的“双吸剂”是否完全失效,写出检验方法 。