现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从大到小的顺序是( )
A.甲>乙>丙B.乙>甲>丙C.甲>丙>乙D.无法判断
铝是重要的轻金属,广泛应用于航空、电讯和建筑领域。铝亦有其特殊的性质,试根据以下信息填空或简答。
(1)按金属的活动性顺序,铝比锌 。但是将铝片和锌粒分别投入稀硫酸中,铝片表面产生的气泡却比锌粒少而慢。为了探究铝与酸反应的规律,小强用相同质量、相同形状的光亮铝片设计如下实验。
实验一 |
实验二 |
实验三 |
实验四 |
|
实验现象 |
铝表面产生气泡很小且慢 |
铝表面产生大量气泡 |
铝表面产生大量气泡 |
铝表面产生大量气泡且快 |
(2)比较实验三、实验四说明铝与酸反应产生氢气的速率,与 有关。
(3)比较实验一、实验二说明铝与酸反应产生氢气的速率,可能与 、 粒子和温度、金属与酸的接触面积等多种因素有关。
(4)写出实验二中发生反应的化学方程式 。
(5)小芳将长条状铝片的一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一段会左右摇晃,却不像蜡烛那样滴落。为探究其原因,小芳查阅资料得知:铝的熔、沸点分别是660℃、2460℃;氧化铝的熔、沸点分别为2054℃、2980℃。
试解释上述实验现象: 。
化学就在我们身边,化学与生产生活息息相关。请回答下列问题:
(1)人类社会的生活和发展离不开常见金属和金属材料。用我们学到的化学知识和方法能分析和解释许多现象。
①下列生活用品,主要利用金属具有良好导热性的是

②下列事实不能用金属活动性顺序解释的
A.铝制品抗腐蚀能力比铁制品强 B.铜能将银从硝酸银溶液中置换出来
C.不能用金属铜与稀硫酸反应制取氢气 D.铁的硬度比铜大
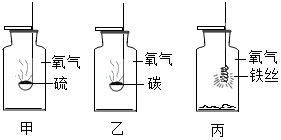
(2)氧气是一种化学性质比较活泼的气体,在点燃和加热的条件下能与许多物质发生化学反应。试回答下列与氧气有关的问题:
①空气中氧气的体积分数约占 。
②如图是一些物质与氧气反应的实验,甲中物质安静燃烧时火焰的颜色是 。任选一个实验,写出一个化学反应的方程式 。
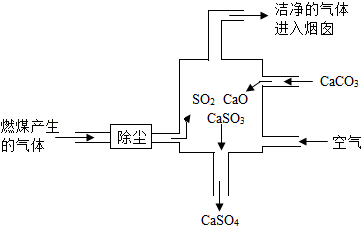
③如图是某燃煤发电厂处理废气的装置示意图,其工艺原理是:向废气处理塔中投入CaCO 3和鼓入空气在高温条件下,将SO 2全部吸收。
(Ⅰ)废气处理塔中发生的反应可用一个总化学方程式表示,写出这个反应的化学方程式: 。
(Ⅱ)若该发电厂每天有16kg二氧化硫产生,则投入的CaCO 3的质量至少是 kg。
将一定质量的铁粉和氧化铜粉末投入到一定质量的稀硫酸中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法:
①滤液M中一定含有硫酸铁,可能含有硫酸和硫酸铜;
②在滤液M中放入一块刚打磨过的锌片,一定有置换反应发生;
③向滤渣N中滴加稀硫酸.可能有气泡产生;
④当滤液M中含有硫酸铜时,滤渣N中一定没有氧化铜
其中一定正确的说法是( )
| A. |
①② |
B. |
②③ |
C. |
③④ |
D. |
①④ |
人类生活生产离不开金属,请回答下列问题:
(1)下列现象和事实,不可以用金属活动性做合理解释的是 (填序号)。
①金属镁在空气中比铝更容易燃烧,说明镁比铝的活动性强
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强
③用硫酸铜、石灰水配置农药波尔多液时,不能用铁制容器
④金属的种类很多,但在自然界中,仅有少数金属如金、银等有单质形式存在
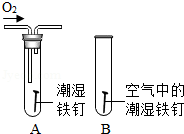
(2)某小组用如图所示装置对铁生锈的条件进行探究,四分钟后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是 。
(3)实验室常用10%的稀盐酸除铁锈,再用浓盐酸配置10%稀盐酸的过程中,除了用到烧杯、量筒和胶头滴管外,还需要用到的仪器是 。
(4)请你设计实验验证铜和银的金属活动性顺序,用化学方程式表示为 。
铁、铜、铝是我们生活中重要的金属材料。
(1)金属铝可以加工成铝箔,主要是利用铝的 性。黄铜是铜锌合金,其硬度比纯铜 (填“大”或“小”)
(2)铁制品易生锈,自行车链条的防锈措施是 工业上常用稀硫酸来除铁锈(主要成分是Fe2O3),该反应的化学方程式是
(3)为了验证铁、铜、铝三种金属的活动性顺序,除了选择铁丝外还需要的两种盐溶液
现有a、b、c三种金属,a、b分别与稀硫酸,c的硝酸盐溶液作用的现象如表所示:
| |
a |
b |
| 与稀硫酸作用 |
无反应 |
溶解并放出气体 |
| 与c的硝酸盐溶液作用 |
表面上析出c |
表面上析出c |
根据表中所给的实验结果,判断这三种金属活动性由强到弱的顺序正确的是( )
| A. |
c、b、a |
B. |
a、b、c |
C. |
b、a、c |
D. |
a、c、b |
金属材料与人类的生产、生活密切相关。
(1)大自然向人类提供了丰富的金属矿物资源,其中提取量最大的是铁。工业上利用赤铁矿石炼铁的原理是 (用化学方程式表示)。实验室用的铁架台是铁的合金制成,合金比纯的金属硬度、强度更高, 也更好。用久的铁架台有一些出现锈迹,学校要对这些铁架台进行除锈,防锈处理,写出除去铁锈所发生的化学反应方程式 ,从实际考虑,学校应对这些除锈后的铁架台做 的防锈处理。
(2)为了比较铜、锌、铁三种金属的活动性强弱,可以将打磨光亮的两根铁丝分别插入 的溶液中,能判断出三种金属的活动性由强到弱的顺序是 。
将铁粉加入到一定量的硝酸银、硝酸铜及硝酸锌的混合溶液中,待充分反应后过滤。向滤渣中加入稀盐酸,没有气体产生,则滤液中的溶质是( )
A.只有硝酸锌
B.一定有硝酸锌和硝酸铁
C.若没有硝酸铜,则一定没有硝酸银
D.一定没有硝酸银
金属材料的研究和应用是化学学习的一个重要内容。
(1)利用铝的 性可将铝块制成铝箔。
(2)工业上用一氧化碳还原赤铁矿冶炼金属铁的化学方程式为 。
(3)因生铁和钢的 不同,导致它们在性能上有很大差异。
(4)验证铝、铜、银的活动性顺序时,除铝、银外还需要用到的一种试剂是 ,除此之外,还可以通过它们与氧气反应的 比较它们的活泼性。
金属材料是重要的资源,在日常生活中已经得到越来越广泛的应用。
(1)将铝片和硬铝片相互刻画,铝片上留下明显的划痕,说明 。
(2)沙漠地区的铁制品锈蚀较慢,其原因是 。
(3)为了比较铁、铜、银三种金属的活动性顺序强弱,某同学设计了下列四种方案:
①将铁丝、银丝分别浸入硫酸铜溶液中;②将银丝分别浸入到硫酸亚铁、硫酸铜溶液中;
③将铜丝、银丝分别浸入到硫酸亚铁溶液中;④将铜丝分别浸入到硫酸亚铁、硝酸银溶液中其中可行的方案是 (填序号)。可行方案中发生的基本反应类型为 。
(4)工业上将赤铁矿石冶炼成铁是一个复杂的过程。炼铁高炉中发生的主要反应有:
①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳的反应;④焦炭充分燃烧,其中体现焦炭作用的反应是 (填序号)。
金属材料在生产、生活中应用广泛.
(1)生铁是常用的铁合金,其硬度比纯铁 (填“大”或“小”).
(2)某同学设计了如图所示的两个实验,验证了Zn、Cu、Ag三种金属的活动性顺序.A中反应的化学方程式为 ;B中X溶液可能是 (填一种即可).

金属材料与人类的生产和生活密切相关。
(1)铜块可以制成铜丝是利用了铜的 性。
(2)为防止钢铁锈蚀,常在其表面涂油漆或镀上其他金属,这些方法能防止钢铁锈蚀的原因是 。
(3)某化学兴趣小组的同学想从含有Al 2(SO 4) 3、CuSO 4的废液中回收金属铜,设计了如图实验。

①I中有关反应的化学方程式 。
②溶液B中所含的溶质是 。
③II中加入过量的稀硫酸的目的是 。
金属在生产、生活中有广泛应用。
(1)我国深水钻井平台"981"用钢量达3万吨,露出平台的钢、铁很容易生锈,钢铁生锈的条件是 ,写出一种防止钢铁生锈的方法 。
(2)写出用盐酸除去铁制品表面铁锈的化学方程式 。
(3)硫酸铜、硫酸亚铁的混合溶液中加入一定量镁粉,充分反应后过滤,得到滤渣和滤液。若滤液呈无色,则滤渣中一定含有的金属是 。