某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如表:
|
加入次数 |
第1次 |
第2次 |
第3次 |
第4次 |
|
加入稀硫酸质量(g) |
100 |
100 |
100 |
100 |
|
充分反应后剩余固体质量(g) |
43.5 |
37 |
35 |
n |
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)所用稀硫酸溶质的质量分数。(写出计算过程)
某同学取110g K2CO3溶液于烧杯中,向其中加入CaCl2溶液。反应过程中加入CaCl2溶液与生成沉淀的质量关系如图所示。
请计算:
(1)m的值是 。
(2)恰好完全反应时,所得溶液的溶质质量分数是多少?(写出计算过程,结果精确到0.01%)

请根据所示的实验过程和提供的信息作答:
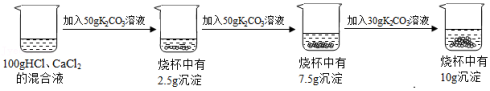
(1)K2CO3中钾、碳、氧元素的质量比为 (写最简比)。
(2)实验结束后溶液中的溶质为 。
(3)实验所用K2CO3溶液的溶质质量分数为 (精确至0.1%)。
(4)计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)
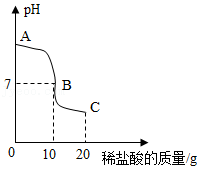
常温下,一锥形瓶中盛有10g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图所示,请回答下列问题:
(1)图中B点溶液呈 色。
(2)计算稀盐酸中溶质质量分数。(写出计算过程)
小苏打(NaHCO 3)是发酵粉的主要成分,可用于制作发面食品。化学兴趣小组为测定某品牌小苏打样品(含NaCl杂质)中碳酸氢钠的含量做了如下实验:将该样品17.1g放入锥形瓶中,加水全部溶解后,得到208.8g样品溶液,向该样品溶液中不断加入稀盐酸(如图),反应过程中锥形瓶中溶液质量的变化如下表所示。(忽略CO 2在水中的溶解)
|
加入稀盐酸的总质量/g |
25 |
50 |
75 |
|
锥形瓶中溶液的质量/g |
229.4 |
250 |
275 |
试计算:
(1)当加入25g稀盐酸时,产生二氧化碳的质量是 g。
(2)17.1g小苏打样品中NaHCO 3的质量(写出计算过程,下同)。
(3)当锥形瓶内样品溶液中的碳酸氢钠与加入的稀盐酸恰好完全反应时,锥形瓶中溶液的溶质质量分数。(计算结果精确至0.1%)

为测定某石灰石样品中碳酸钙的质量分数,取2.0g石灰石样品于烧杯中,将20g稀盐酸分4次加入样品中,充分反应后经过滤,干燥、称重,得实验数据如表:
|
第一次 |
第二次 |
第三次 |
第四次 |
|
|
稀盐酸的用量/g |
5.0 |
5.0 |
5.0 |
5.0 |
|
剩余固体的质量/g |
1.5 |
1.0 |
0.5 |
0.3 |
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法正确的是( )
A.第三次实验后碳酸钙无剩余
B.第四次实验后盐酸无剩余
C.盐酸中HCl的质量分数是3.65%
D.样品中碳酸钙的质量分数是85%
请你仔细分析如图所示的实验过程和提供的数据,并进行计算。

(1)反应后烧杯中溶液质量为 g。
(2)反应后所得溶液的溶质质量分数(写出计算过程,精确到0.1%)。
现有一定质量的碳酸钠和氯化钠的固体混合物,其中含氯元素7.1g。向该混合物中加入138.1g一定溶质质量分数的稀盐酸,恰好完全反应,得到氯化钠溶液并生成4.4g气体。计算:
(1)原固体混合物中氯化钠的质量;
(2)反应后所得溶液中溶质的质量分数。
白铜(Cu﹣Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:

试问:
(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数(写出计算过程)。
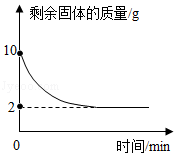
某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入192g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示。
(1)所取粉末中氧化铜的质量为 g;
(2)计算反应后所得溶液溶质质量分数。(规范写出计算过程)
实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
在82.8克碳酸钠溶液中,逐滴加入盐酸,所加盐酸的质量与产生气体的质量关系如图所示(滴加过程中先发生化学反应:Na2CO3+HCl═NaHCO3+NaCl)。试计算(不考虑气体的溶解和盐酸的挥发):

(1)m的值为 。
(2)刚好不再产生气体时,溶液中溶质的质量分数(写出化学方程式及计算过程)。
某实验小组验证“Fe+Ag2SO4═FeSO4+2Ag”反应并进行了如下探究。已知银粉为黑色,22℃时Ag2SO4的溶解度为0.8g。
①22℃时,向盛有硫酸银饱和溶液的烧杯中加入过量铁粉,搅拌静置,观察到溶液变为黄色并逐渐加深。
②静置3小时后观察,烧杯底部仍有黑色粉末,溶液黄色几乎消失。
③用pH试纸检测Ag2SO4、FeSO4溶液,测得pH均小于7。
回答下列问题:
(1)22℃时,硫酸银饱和溶液显 性(填“酸”“碱”或“中”),其溶质质量分数为 。(列出计算式即可)
(2)取步骤①上层的黄色溶液少许滴加盐酸,观察到白色沉淀,该沉淀的化学式为 。
(3)某同学由步骤②中“仍有黑色粉末”得出Fe比Ag活泼的结论。小组同学讨论后认为思维不严密,因为黑色粉末不一定含Ag,还可能是 ,需要进一步实验才能得出结论,该实验方案是:取黑色粉末少许, 。(补充完实验方案)
(4)溶液呈黄色是因为含有Fe3+离子。小组对Fe3+产生的原因作出如下假设:
a.可能是铁粉表面有氧化物,可产生Fe3+;
b.空气中的O2能与Fe2+反应,可产生Fe3+;
c.溶液中存在 离子能与Fe2+反应,可产生Fe3+。
请设计实验证明假设a、b不是产生Fe3+的主要原因。实验方案是:向同样的铁粉中加入FeSO4溶液,振荡静置,观察到 时即可证明。
小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
|
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
|
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
|
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?