某固体物质中可能含有NaCl、BaCl2、NaOH中的一种或几种。某校课外小组同学为了探究其成分,取该固体物质30g完全溶于水中,测得溶液的pH为7,然后将70g某稀硫酸加入该溶液中,充分反应,所加硫酸的量与产生沉淀的关系如图所示。请根据图示及相关知识回答问题。
(1)该固体物质中一定不含有的物质是 (化学式)。
(2)通过计算确定固体物质的组成成分及质量。
(3)这种稀硫酸中溶质的质量分数是多少?

赤铁矿石的主要成分为氧化铁。将10g赤铁矿石样品(杂质既不溶于水,也不参加反应)放入烧杯中,再加入92g稀硫酸,恰好完全反应,过滤,得到滤液和2g滤渣。请计算:
(1)赤铁矿石样品中氧化铁的质量分数。
(2)反应后所得溶液中溶质质量分数。
建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验:取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
(1)20g赤铁矿石样品中氧化铁的质量为 g;
(2)该样品中铁元素的质量分数为 ,由此判断出该赤铁矿石 (填“属于”或“不属于”)富铁矿石。
(3)计算实验中所用稀盐酸溶质的质量分数(写出计算过程)。

小明用石灰石测定某稀盐酸中溶质的质量分数,向盛有100g稀盐酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:
|
实验次数 |
第一次 |
第二次 |
|
石灰石粉末质量/g |
15 |
15 |
|
烧杯中物质总质量/g |
109.5 |
121.2 |
(1)共生成二氧化碳 g。
(2)所用稀盐酸中溶质的质量分数。
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液68.0g,加入二氧化锰2.0g,待完全反应不再有气体逸出时,称得得剩余物质的总质量为68.4g。计算:
(1)反应完全后产生氧气的质量是 g。
(2)该过氧化氢溶液中溶质的质量分数(写出计算过程)
在100g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl═HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7g的AgCl沉淀,求盐酸的溶质质量分数。
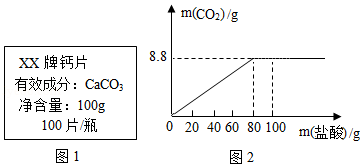
钙是人体中的常量元素,因缺钙而导致骨质疏松、佝偻病等的患者应在医生的指导下服用钙片。某补钙药剂说明书的部分信息如图1所示。现将100g盐酸分成五等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与关系图如图2.请根据有关信息回答问题。
|
实验次数 |
第一次 |
第三次 |
第四次 |
|
加入盐酸的质量(g) |
20 |
20 |
20 |
|
剩余固体的质量(g) |
35 |
a |
20 |
(1)该品牌补钙药剂中CaCO 3的质量分数是 ,a的数值为 。
(2)该盐酸中溶质的质量分数是多少?(写出计算过程,计算结果精确至0.1%)
欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
|
稀盐酸的质量 |
充分反应后剩固体的质量 |
|
第一次加入20g |
8g |
|
第二次加入20g |
6g |
|
第三次加入20g |
4g |
|
第四次加入20g |
2g |
|
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
某实验小组验证“Fe+Ag2SO4═FeSO4+2Ag”反应并进行了如下探究。已知银粉为黑色,22℃时Ag2SO4的溶解度为0.8g。
①22℃时,向盛有硫酸银饱和溶液的烧杯中加入过量铁粉,搅拌静置,观察到溶液变为黄色并逐渐加深。
②静置3小时后观察,烧杯底部仍有黑色粉末,溶液黄色几乎消失。
③用pH试纸检测Ag2SO4、FeSO4溶液,测得pH均小于7。
回答下列问题:
(1)22℃时,硫酸银饱和溶液显 性(填“酸”“碱”或“中”),其溶质质量分数为 。(列出计算式即可)
(2)取步骤①上层的黄色溶液少许滴加盐酸,观察到白色沉淀,该沉淀的化学式为 。
(3)某同学由步骤②中“仍有黑色粉末”得出Fe比Ag活泼的结论。小组同学讨论后认为思维不严密,因为黑色粉末不一定含Ag,还可能是 ,需要进一步实验才能得出结论,该实验方案是:取黑色粉末少许, 。(补充完实验方案)
(4)溶液呈黄色是因为含有Fe3+离子。小组对Fe3+产生的原因作出如下假设:
a.可能是铁粉表面有氧化物,可产生Fe3+;
b.空气中的O2能与Fe2+反应,可产生Fe3+;
c.溶液中存在 离子能与Fe2+反应,可产生Fe3+。
请设计实验证明假设a、b不是产生Fe3+的主要原因。实验方案是:向同样的铁粉中加入FeSO4溶液,振荡静置,观察到 时即可证明。
小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
|
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
|
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
|
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
为测定某盐酸的溶质质量分数,取200g样品于烧杯中,将50g碳酸钠溶液分为5等份,分5次加入盛有样品的烧杯中。测出每次反应后溶液的总质量,实验数据如下表:
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入Na2CO3溶液的质量 |
10g |
10g |
10g |
10g |
10g |
|
反应后溶液的质量 |
208.9g |
217.8g |
226.7g |
235.6g |
245.6g |
请根据实验数据计算盐酸的溶质质量分数。
将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:
已知:Al(OH) 3+NaOH═NaAlO 2+2H 2O
(1)B点溶液中所含溶质是 (填化学式)。
(2)求图中A点的坐标: 。
(3)原混合溶液中MgCl 2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)

实验室用34g过氧化氢溶液和2g二氧化锰混合制取氧气。完全反应后剩余物质总质量为35.2g。请计算:
(1)生成氧气的质量为 g。
(2)求所用过氧化氢溶液溶质的质量分数。(根据化学方程式进行计算,写出计算过程)