欲测定一瓶标签破损的硫酸铜溶液的溶质质量分数,现取50g硫酸铜溶液样品于烧杯中,逐滴加入10%的NaOH溶液。生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示。回答下列问题:
(1)图中x= 。
(2)计算硫酸铜溶液的溶质质量分数。(写出计算过程)

向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
(1)当加入NaOH溶液质量为ag时,溶液中含有的溶质为 。
(2)原混合溶液中,溶质H2SO4的质量(写出计算过程,下同)
(3)恰好完全反应时,消耗NaOH溶液的总质量。

小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图象如图乙。(碱石灰能吸收二氧化碳和水) 
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到0.1%)
(2)下列情况中,会导致测得的碳酸钙质量分数偏大的是 。
①去掉装置A,将空气直接鼓入装置B
②去掉装置C,将B与D装置直接相连
③当气泡停止产生时立即停止鼓入空气
白铜(Cu﹣Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:

试问:
(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数(写出计算过程)。
洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215.6g。试计算下列问题:
[知识卡片]洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
(1)产生的二氧化碳质量为 克。
(2)该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程。)
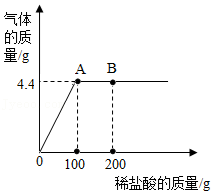
现有一定质量的碳酸钠和氯化钠的固体混合物,其中含氯元素7.1g。向该混合物中加入138.1g一定溶质质量分数的稀盐酸,恰好完全反应,得到氯化钠溶液并生成4.4g气体。计算:
(1)原固体混合物中氯化钠的质量;
(2)反应后所得溶液中溶质的质量分数。
电解法是工业上制铜的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO 4+2H 2O  2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
回答下列问题:
(1)原硫酸铜溶液中溶质的质量分数是多少?(写出解题过程)
(2)向电解后得到的488.0g溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同。则这种物质可能是下列物质中的 (填选项编号)
A.Cu B.CuO C.Cu(OH) 2D.CuCO 3
实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
我国制碱工业先驱侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展作出了杰出的贡献。纯碱的用途非常广泛,某化学兴趣小组的同学对它产生了浓厚的兴趣,设计了如图两个实验,并对反应后试管中残留废液进行探究。
【实验1】往一支盛有碳酸钠溶液的试管中滴加无色酚酞溶液,观察到溶液变成 色。
【实验2】往另一支盛有碳酸钠溶液的试管中滴加稀盐酸,观察到的现象是 。同学们对实验2反应后的废液中溶质成分进行探究。
【提出问题】废液中所含溶质是什么?
【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl
猜想二:废液中的溶质可能是NaCl、Na2CO3
猜想三:废液中的溶质可能是
【设计实验】同学们为验证猜想,设计了如下实验:
方案一:
|
实验操作与现象 |
反应方程式 |
实验结论 |
|
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生 |
|
猜想二正确 |
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。
【进行讨论】同学们一致认为小明的实验结论不正确,理由是 。
【进行总结】分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑 。
【拓展与应用】现有14.9克纯碱样品(含Na2CO3和NaCl的混合物),将其放入干净的烧杯中,加入89.5克水使其完全溶解,向所得溶液中缓慢加入一定溶质质量分数的稀盐酸(反应方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O)。产生气体的质量与加入稀盐酸的质量关系如图所示,试回答下列问题:
(1)产生CO2的质量为 克。
(2)所用稀盐酸中溶质的质量分数是多少? (写出具体的解题过程,下同)
(3)滴入稀盐酸至恰好完全反应时,所得溶液中溶质的质量分数是多少?

某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
|
稀盐酸的质量 |
充分反应后剩固体的质量 |
|
第一次加入20g |
8g |
|
第二次加入20g |
6g |
|
第三次加入20g |
4g |
|
第四次加入20g |
2g |
|
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
某实验小组验证“Fe+Ag2SO4═FeSO4+2Ag”反应并进行了如下探究。已知银粉为黑色,22℃时Ag2SO4的溶解度为0.8g。
①22℃时,向盛有硫酸银饱和溶液的烧杯中加入过量铁粉,搅拌静置,观察到溶液变为黄色并逐渐加深。
②静置3小时后观察,烧杯底部仍有黑色粉末,溶液黄色几乎消失。
③用pH试纸检测Ag2SO4、FeSO4溶液,测得pH均小于7。
回答下列问题:
(1)22℃时,硫酸银饱和溶液显 性(填“酸”“碱”或“中”),其溶质质量分数为 。(列出计算式即可)
(2)取步骤①上层的黄色溶液少许滴加盐酸,观察到白色沉淀,该沉淀的化学式为 。
(3)某同学由步骤②中“仍有黑色粉末”得出Fe比Ag活泼的结论。小组同学讨论后认为思维不严密,因为黑色粉末不一定含Ag,还可能是 ,需要进一步实验才能得出结论,该实验方案是:取黑色粉末少许, 。(补充完实验方案)
(4)溶液呈黄色是因为含有Fe3+离子。小组对Fe3+产生的原因作出如下假设:
a.可能是铁粉表面有氧化物,可产生Fe3+;
b.空气中的O2能与Fe2+反应,可产生Fe3+;
c.溶液中存在 离子能与Fe2+反应,可产生Fe3+。
请设计实验证明假设a、b不是产生Fe3+的主要原因。实验方案是:向同样的铁粉中加入FeSO4溶液,振荡静置,观察到 时即可证明。
小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
|
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
|
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
|
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
为测定某盐酸的溶质质量分数,取200g样品于烧杯中,将50g碳酸钠溶液分为5等份,分5次加入盛有样品的烧杯中。测出每次反应后溶液的总质量,实验数据如下表:
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入Na2CO3溶液的质量 |
10g |
10g |
10g |
10g |
10g |
|
反应后溶液的质量 |
208.9g |
217.8g |
226.7g |
235.6g |
245.6g |
请根据实验数据计算盐酸的溶质质量分数。
将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:
已知:Al(OH) 3+NaOH═NaAlO 2+2H 2O
(1)B点溶液中所含溶质是 (填化学式)。
(2)求图中A点的坐标: 。
(3)原混合溶液中MgCl 2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
