如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( )

A.三种物质的溶解度大小关系为甲>乙>丙
B.t2℃时,将20g甲加入50g水中,得到70g溶液
C.t3℃时,用等质量的甲、乙、丙固体配成饱和溶液,需要水的质量大小关系是乙>甲>丙
D.将t2℃的三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为乙>丙>甲
如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )

A.a的溶解度大于b的溶解度
B.P点表示t1℃时a、c两物质溶解度相等
C.将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液
D.将t2℃,a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为:b>a=c
NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是( )
温度/℃ |
0 |
20 |
40 |
60 |
NaCl的溶解度/g |
35.7 |
36.0 |
36.6 |
37.3 |
KNO3的溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
A.20℃时,100g H2O最多能溶解36.0g NaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
不同温度下KNO3的溶解度如下表所示。下列说法正确的是( )
温度/℃ |
20 |
30 |
40 |
溶解度/g |
31.6 |
45.8 |
63.9 |
A.20℃时,100g KNO3饱和溶液中溶质质量为31.6g
B.30℃时,100g KNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50g KNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9g KNO3
甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )

A.甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )

A.甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,

可以作出的正确判断是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
下列说法正确的是( )

A.水灭火的主要原理是水吸热降低了可燃物的着火点
B.用蒸馏的操作净化水不能降低水的硬度
C.根据如图可知,降温可使氢氧化钙饱和溶液变为不饱和溶液
D.20℃时,KCl的溶解度为34g,该温度下,100g KCl饱和溶液中溶质KCl的质量为34g
如图是化合物M和化合物N的溶解度曲线。下列说法中错误的是( )

A.30℃时,M和N的溶解度相等
B.将60℃时N的饱和溶液降温至40℃,有晶体析出
C.M的溶解度随温度的升高而增大
D.N的饱和溶液在40℃时溶质质量分数最大
如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法错误的是( )

A.T2℃时,向各装有50g水的三个烧杯中,分别加入甲、乙、丙固体各40g,充分搅拌后形成饱和溶液的是乙和丙
B.甲中混有少量的乙,提纯甲的常用方法是降温结晶
C.在T1℃时,将接近饱和的丙溶液变为饱和溶液,溶剂的质量可能不变
D.将T2℃的甲、乙、丙饱和溶液温度降至T1℃,溶液中溶质的质量分数大小关系为乙=丙>甲
如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是( )

A.甲和乙两物质的饱和溶液温度从t3℃降至t2℃时,析出晶体质量甲>乙
B.将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C.甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D.t1℃时,30g丙物质加入到50g水中形成溶液的质量为80g
以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
|
Na2CO3的溶解度(g/100g水) |
7.1 |
12.5 |
21.5 |
39.7 |
49.0 |
48.5 |
46.0 |
NaHCO3的溶解度(g/100g水) |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的 NaHCO3会部分析出
根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A.无法判断a中溶液是否为饱和溶液
B.c中溶液溶质的质量分数为33.3%
C.b中溶液在加热过程中始终为饱和溶液
D.常用冷却热的饱和溶液的方法获得氯化钠晶体
T℃时,向盛有100g水的两烧杯中分别加入60g甲、乙两种固体,搅拌后固体甲完全溶解,放置一段时间后,甲溶液中有固体析出,溶解度曲线如图所示。下列说法正确的是( )
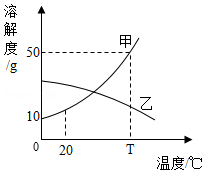
A.搅拌的目的是增大物质的溶解度
B.将T℃的甲、乙两种饱和溶液降温,溶质质量分数都减小
C.甲溶于水的过程中一定放出热量
D.乙是可溶性物质