我国制碱工业的先驱一侯德榜成功地摸索和改进了西方的制碱方法。下表为侯氏制碱法中部分物质的溶解度。
温度/℃ |
10 |
20 |
30 |
40 |
|
溶解度/g |
Na2CO3 |
12.2 |
21.8 |
39.7 |
48.8 |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
|
(1)由上表可知,在10℃﹣40℃之间溶解度随温度变化最小的物质是 (填名称)。
(2)40℃时,将等质量的三种表中物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数由大到小的顺序是 (用化学式表示)。
(3)侯氏制碱法制得的碱为纯碱,纯碱的化学式为 。
(4)制碱原理为向饱和的NaCl溶液中通入足量NH3和CO2生成 NaHCO3晶体和NH4Cl,NaHCO3加热分解即制得纯碱。
①生成 NaHCO3的化学方程式为 。
②结合上表分析,析出 NaHCO3晶体的原因可能有 (填序号)。
A.溶剂质量减少
B.同温下 NaHCO3溶解度小于NaCl
C.生成的NaHCO3质量大于消耗的NaCl质量
小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见右表).通过分析她得出以下结论,其中不正确的是( )
20℃ |
40℃ |
|
水 |
109g |
129g |
酒精 |
17.3g |
40g |
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃,40gNaOH溶解在l00g酒精中达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃,析出的晶体前者比后者多
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
4Cl溶液,经过如下操作后,得到固体。
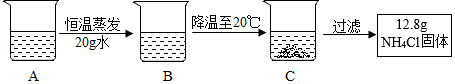
I.C中溶液的质量是 4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
4Cl固体的温度在40℃至50℃之间。
如表为氯化钠和氯化铵在不同温度时的溶解度,请回答下列问题
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
4Cl溶解度/g |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
49.6 |
NaCl溶解度/g |
35.4 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是 ;
(2)20℃时,100g水最多能溶解NaCl g;
(3)向烧杯中加入100g水和49.0g氯化铵配成50℃的溶液,此时溶液为 溶液(填“饱和”或“不饱和”);再冷却到20℃,烧杯中析出固体的质量为 g。
根据如表数据,回答问题。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
KNO 3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
| NaCl |
25.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
(1)20℃时KNO 3的溶解度是 g;
(2)60℃时,200gKNO 3溶液中含溶质 100g,将该溶液降温至 20℃,可析出KNO 3 g;
(3)NaCl溶液中含有少量KNO 3,提纯NaCl,采用的方法是 (选填"蒸发结晶"或"降温结晶")。
A,B,C三种固体物质的溶解度曲线如图所示,回答下列问题:
(1)当A中混有少量的B,常用的提纯方法是 .
(2)将A,B,C三种物质的饱和溶液从t 2℃将到t 1℃,所得溶液中溶质的质量分数关系由大到小的顺序是 .
(3)说出图中P点表示的意义 .
(4)t 1℃,将50gA物质放于50g水中,充分溶解后,所得溶液的质量是 g.

如表是NaCl和KNO 3在不同温度下的溶解度,有关说法不正确的是( )
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
| 溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
| KNO 3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
|
| A. |
NaCl的溶解度比KNO 3的溶解度大 |
| B. |
两种物质溶解度相等的温度在20℃~30℃之间 |
| C. |
20℃时,NaCl的溶解度为36.0g |
| D. |
60℃时,将11gKNO 3加入10g水中充分溶解,溶液刚好饱和 |
已知KNO3在20℃时的溶解度是31.6g,求此温度下将15.8g KNO3固体溶于水配成饱和溶液,需加水 克,所得溶液的溶质质量分数是 。
20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如表:
| 实验小组 |
第一组 |
第二组 |
第三组 |
第四组 |
| 水的质量/g |
50 |
50 |
50 |
50 |
| 所取NaCl的质量/g |
15 |
20 |
25 |
30 |
| 剩余NaCl的质量/g |
0 |
2 |
7 |
12 |
下列说法错误的是( )
| A. |
20℃时,50g NaCl饱和溶液中含有18g NaCl |
| B. |
用蒸发的方法可以使不饱和溶液变成饱和溶液 |
| C. |
第二组所得溶液的溶质与溶剂的质量比为9:25 |
| D. |
相同温度下,NaCl在水里的溶解度与水的质量无关 |
如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/克 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
A.20℃时,100克水中溶解的硝酸钾越多溶解度就越大
B.40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克
C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
D.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小
某同学对下表中的溶解度数据分析后,得出的结论错误的是( )
温度/℃ |
0 |
20 |
40 |
60 |
氢氧化钙的溶解度/g |
0.18 |
0.16 |
0.14 |
0.11 |
硝酸钾的溶解度/g |
13.3 |
31.6 |
61.9 |
110 |
氯化钠的溶解度/g |
35.7 |
36 |
36.6 |
37.2 |
A.升温可将20℃时不饱和的Ca(OH)2溶液变为饱和溶液
B.60℃,饱和KNO3溶液的质量分数约为52.4%
C.温度变化对NaCl的溶解度影响较小
D.NaCl的溶解度大于KNO3的溶解度
根据如图所示溶解度曲线判断,下列说法正确的是( )
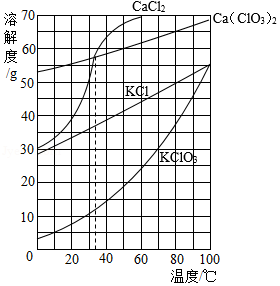
A.20℃时,将10 g KClO3加入100 g水中,溶液质量为110 g
B.30℃时,KCl饱和溶液中溶质的质量分数约为35%
C.分别将35℃的CaCl2和Ca(ClO3)2两种饱和溶液升温至40℃,CaCl2溶液中溶质的质量分数较大
D.除去CaCl2中混有的少量Ca(ClO3)2,可在较高温度配成饱和溶液,再降温结晶、过滤
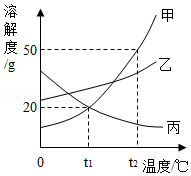
如图是甲,乙、丙三种固体物质的溶解度曲线,据图回答下列问题:
(1)P点的含义是 。
(2)t 2℃时,把50g甲中加入到200g水中充分搅拌,静置,形成的是 溶液(填"饱和"或"不饱和")。
(3)稍微加热丙的饱和溶液即出现浑浊现象,其原因是 。
(4)除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、 、过滤、洗涤、干燥。
(5)将t 2℃时等质量的甲、乙两物质的饱和溶液分别降温至t 1℃,对所得溶液的叙述正确的是 (填字母序号)
A.溶剂质量:甲>乙 B.析出晶体质量:甲>乙
C.溶质质量分数:甲<乙
NaCl、CaCl 2的部分溶解度数据见下表。
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 (g/100g水) |
NaCl |
36.0 |
36.6 |
37.1 |
38.0 |
39.2 |
| CaCl 2 |
27.6 |
39.8 |
41.4 |
43.2 |
45.2 |
|
①由上表可知:20℃时,NaCl的溶解度是 g/100g水;60℃时,溶解度相对较大的物质是 。
②某NaCl固体中含有CaCl 2杂质,分别取样进行实验。
【测定杂质含量】
取10.0g样品溶于水,加入足量Na 2CO 3溶液,与CaCl 2反应生成NaCl和0.01mol CaCO 3沉淀,计算样品中CaCl 2的质量。(根据化学方程式列式计算) 。
【提纯NaCl】取30g样品,依据两种物质的溶解度差异设计实验并提纯NaCl。
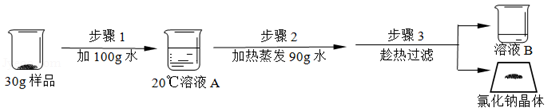
Ⅰ.溶液A是NaCl的 (选填"饱和"或"不饱和")溶液;
Ⅱ.溶液A中CaCl 2的质量分数 (选填"大于""小于"或"等于")溶液B中CaCl 2的质量分数;
Ⅲ.为达成实验目的,上述三个步骤在试剂用量、实验操作等方面都有综合考虑,请写出其设计意图 。