某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )
A.变大 不变B.变大 变小C.不变 变大D.不变 不变
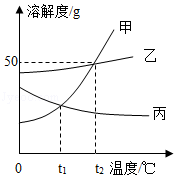
如图是甲、乙、丙三种固体的溶解度曲线图。据图回答下列问题:
(1)乙、丙两物质在 ℃时溶解度相等。
(2)将t2℃时甲的饱和溶液变为不饱和溶液,在保证溶液质量不改变的前提下可采取的方法是 。
(3)t2℃时欲配制50g 15%的乙物质的溶液,需量取水 mL.(水的密度为1g•cm﹣3)
(4)t3℃时,将三种物质各ag分别加入100g水中,充分溶解后,只有一种物质形成不饱和溶液,则a的取值范围是 。

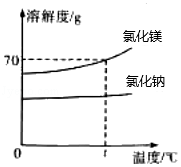
大连复州湾盐场是我国四大海盐场之一,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质。如图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中, 的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为 。
(3)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是 。
(4)海水晒盐是利用 的方法获得晶体。
某同学测得B物质的溶解度如表所示:
温度(℃) |
0 |
20 |
40 |
60 |
80 |
B物质的溶解度(g) |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
(1)根据表中测出的溶解度数据,在答题卡上相应位置画出B物质的溶解度曲线图。

(2)根据图1可知,T= ℃时,C物质的溶解度等于A物质的溶解度。
(3)要使接近饱和的A、B、C三种溶液都变为饱和溶液,可采用的相同方法是 (任填一种)。
(4)30℃时,将C物质的饱和溶液150g,稀释成质量分数为25%的溶液,需要向其中加水 g。
(5)如图2所示:常温下分别向装有适量A、C物质的两支试管里加入等量蒸馏水,充分振荡后,两支试管底部均有未溶解的固体。再将两支试管放入盛有冰水混合物的烧杯中,看到的实验现象是:装C物质的试管中固体增多,装A物质的试管中固体减少。请你对此现象做出解释: 。
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.乙的饱和溶液升温后溶质的质量分数会变大
B.仅用降温至0℃的方法可将a点的甲溶液转化为饱和溶液
C.t2℃时等质量的甲、乙饱和溶液中溶剂质量:甲<乙
D.除去甲中混有的少量乙宜采用的结晶方法是

KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是( )

A.NaCl的溶解度受温度影响的程度比KNO3的大
B.T1时,KNO3的溶解度比NaCl的大
C.T2时,KNO3与NaCl的饱和溶液质量分数相等
D.将T1时KNO3的不饱和溶液升温至T2,溶液变为饱和(不考虑溶剂蒸发)
如图是硝酸钾(KNO3)和氯化钾(KCl)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3 KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为 g。
(3)KNO3中混有少量的KCl,可用 的方法提纯KNO3。
(4)据图,下列有关说法正确的是 。
A.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
B.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
C.将60℃时KNO3和KCl两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
D.60℃时,从KNO3和KCl两种饱和溶液中获得等质量晶体,蒸发水较多的是KCl溶液

甲、乙试管中各盛有10.0g水,向其中一支中加入3.0g KNO3固体,另一支中加入3.0g NaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是( )

A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯
D.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
下列关于溶液的说法正确的是( )
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
作图法是常用的数据处理方法。如图是A、B、C三种物质的溶解度曲线图,请回答下列问题:
(1)P点的意义是 。
(2)t3℃时,A、B、C三种物质溶解度最大的是 。
(3)将某温度下C的不饱和溶液变成饱和溶液的方法是 (写一种)。
(4)在t3℃时,将A、B、C的饱和溶液分别降温到t1℃时,所得溶液溶质的质量分数由大到小的顺序是 。

如图为硝酸钾、氯化钠两种物质的溶解度曲线,据图回答下列问题。
(1)在 ℃时,硝酸钾和氯化钠的溶解度相等。
(2)将40℃时接近饱和的硝酸钾溶液变为饱和溶液,可采用 (填“升高”或“降低”)温度的方法。
(3)比较在40℃时硝酸钾和氯化钠饱和溶液的溶质质量分数,硝酸钾 氯化钠(填“>”“=”“<”)。

甲、乙、丙三种物质的溶解度曲线如图所示。下列说法不正确的是( )
A.t 1℃时,甲和丙的溶解度相等
B.降低温度可使丙的不饱和溶液变成饱和溶液
C.甲中含有少量乙时,可采用降温结晶的方法提纯甲
D.t 2℃时,向80g水中加入20g甲,溶解后其溶质质量分数为20%
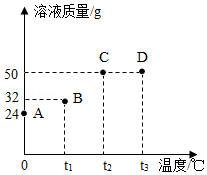
将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是 (填字母编号)。
(2)0℃时,物质X的溶解度是 。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是 (填字母编号)。
(4)下列说法正确的是 (填序号)。
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
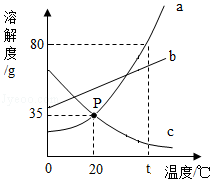
如图是a、b、c三种固体物质(均不含结晶水)的溶解度曲线图。请根据图示回答下列问题:
(1)20℃时,溶解度最大的是 。
(2)欲将c物质的饱和溶液变为不饱和溶液,可采用的方法是 (填“降低”或“升高”)温度。
(3)20℃时,向30g物质a中加入50g水,充分溶解并恢复到原温度,所得溶液中溶质的质量为 g。
(4)下列说法正确的是 。
A.当b中混有少量a时,可用蒸发结晶的方法提纯b
B.20℃时,用a、b、c三种固体配制等质量的饱和溶液,所需水的质量大小关系是b>a=c
C.将20℃的a、b、c三种物质的饱和溶液升温至t℃,所得溶液中溶质的质量分数大小关系为b>a>c