溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是 (填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表Ⅰ是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 |
OH﹣ |
Cl﹣ |
CO32﹣ |
SO42﹣ |
K+ |
溶 |
溶 |
溶 |
溶 |
Mg2+ |
不 |
溶 |
微 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
表Ⅰ空格中应填写 ;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是 。
温度 (℃) |
0 |
10 |
20 |
30 |
40 |
氯化钠(g) |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠(g) |
6 |
10 |
18 |
36.5 |
50 |
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理 。
溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中, 的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是 g。
(3)将70℃时三种物质的饱和溶液分别降温至30℃,所得溶液为不饱和溶液的是 溶液。
(4)硝酸钾属于复合肥料,所含营养元素有 ,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量 kg。

如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )

A.a属于易溶性物质
B.t℃时c物质的饱和溶液,可采用升高温度方法使其变为不饱和溶液
C.90℃时,将50ga物质加入到50g水中充分搅拌,可得到100ga的饱和溶液
D.将20℃时三种物质的饱和溶液升温到90℃,所得溶液中溶质的质量分数的大小关系是:a>c>b
一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )

A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
为探究物质溶解过程中的能量变化,某同学设计图Ⅰ所示装置。在盛有水的烧杯中放入一装有饱和硝酸钾溶液的试管,向水中加入足量物质X,搅拌。结合图Ⅱ硝酸钾溶解度曲线,对硝酸钾溶液变化的推断,合理的是( )
①X为NaCl固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
②X为NaOH固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
③X为NH4NO3晶体,试管中有晶体析出,硝酸钾溶液仍是饱和溶液
④X为浓H2SO4,试管中无晶体析出,硝酸钾溶液为不饱和溶液
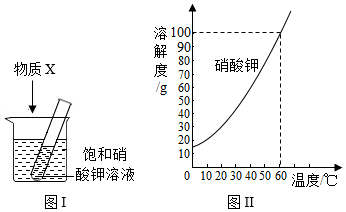
A.①②③B.①③④C.①②④D.②③④
甲、乙、丙三种物质的溶解度曲线如图1所示。回答下列问题:

(1)当温度为 ℃时,甲、丙两种物质的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质和溶液的质量比为 。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)R是甲,乙、丙三种物质中的一种,现用R作图2实验,①②中没有固体析出,③中有固体析出。根据图示信息,以下几种说法正确的是 (填标号)。

A.R是甲物质
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
如图是A、B、C三种物质的溶解度曲线,请认真分析并回答:
(1)t3℃时,A、B、C三种物质的溶解度由小到大的顺序为 。
(2)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时变为不饱和溶液的是 。
(3)当A中含有少量的B,可采用 (填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t3℃时,若用A、B两物质各50g配成饱和溶液,则所需加水的质量A B(填“>”,“<”,“=”号)

a、b、c三种固体物质的溶解度曲线如图所示。下列说法正确的是( )

| A. |
t 1℃时,a物质的溶解度是30g |
| B. |
t 2℃时,b的饱和溶液中溶质的质量分数为50% |
| C. |
t 3℃时,各取15g a、b、c三种物质分别加入到50g水中充分溶解,能得到饱和溶液的是c |
| D. |
t 2℃和t 3℃时的两份b溶液,所含溶质的质量不可能相等 |
A、B、C三种固体物质的溶解度曲线如图所示,请完成下列问题:
(1)t3℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(2)t2℃时,配制140g A物质的饱和溶液需要A物质的质量是 g;
(3)现有t1℃接近饱和的C溶液,在不改变溶液中溶质的质量分数的前提下,要使其变为饱和的溶液,可采取的一种措施是 ;
(4)若B中含有少量的A物质,可采用 方法提纯B。

甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

科学发现往往源于对实验现象的观察与研究。
(1)如图甲进行白糖溶解实验,根据图中现象判断:溶液② (填“是”“不是”或“可能是”)白糖的饱和溶液。

(2)如图乙所示,小科利用集气瓶收集从导管导出的氧气时,每隔一段时间,他就取出导管,再用带火星的木条放在瓶口验满。可是他始终没有观察到带火星木条复燃,小科实验操作中出现的错误是 。
为探究硝酸钾的溶解性,进行了如图实验(见图Ⅰ),结合KNO3溶解度曲线(见图Ⅱ)判断,下列说法错误的是( )

A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.溶液②、溶液③的质量:③>②
D.溶液②、溶液③、溶液④的溶质质量分数:③>②=④
如图是KNO 3、NaCl两种物质的溶解度曲线。下列说法错误的是( )

| A. |
一定质量的KNO 3饱和溶液由t 2℃降到t 1℃时,溶液的质量不变 |
| B. |
P点表示t 2℃时,KNO 3溶液为不饱和溶液,NaCl溶液为饱和溶液 |
| C. |
KNO 3的溶解度受温度影响比NaCl的大 |
| D. |
t 1℃时KNO 3和NaCl的溶解度相等 |
小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
| 序号 |
温度/℃ |
水的质量/克 |
加入硝酸钾的质量/克 |
所得溶液的质量/克 |
| ① |
10 |
100 |
40 |
120.9 |
| ② |
60 |
100 |
40 |
140 |
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小