我国将力争2060年前实现碳中和。CO2的捕捉是减少碳排放的措施之一。
(1)一种利用NaOH溶液捕捉回收CO2的过程如图所示。
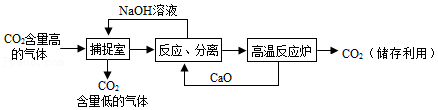
①捕捉室中NaOH溶液常喷成雾状,优点是 。
②“反应分离“环节发生的复分解反应是 (写化学方程式)。
③“反应分离”环节分离物质采用的方法是 。
④CO2用途广泛,写出一种用途: 。
(2)CaO固体也可以捕捉回收CO2。研究表明CaC2O4•H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46g CaC2O4•H2O进行加热,固体质量随温度变化如图。
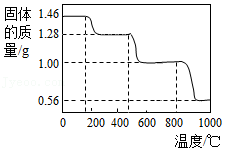
①写出400~600℃范围内分解反应的化学方程式: (CaC2O4•H2O的相对分子质量:146)。
②据图分析,CaO捕捉CO2的反应温度应 (填“高于”或“低于”)800℃。
A﹣F是初中化学常见的6种物质,分别由C、H、O、S、Fe、Cu中的一种或几种元素组成。已知A、C是单质,B、C、D、E是不同类别的物质,E的固体俗称“干冰”,F是氧化物,F中两种元素的质量比为4:1.这些物质之间的相互关系如图所示,图中“﹣”表示能相互反应,“→”表示转化关系(部分反应物、生成物及反应条件已略去)。
(1)写出A、D的化学式:A ;D 。
(2)写出E的一种用途: 。
(3)写出D→E反应的基本反应类型: 反应。
(4)写出B﹣C、F→E反应的化学方程式:B﹣C: ;F→E: 。
