某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.【探究一】影响过氧化氢分解快慢的因素
分别取5mL H2O2溶液进行实验,测定产生4mL O2所需时间,实验结果记录如下:
实验序号 |
H2O2溶液的溶质质量分数% |
温度℃ |
MnO2粉末用量/g |
反应时间 |
① |
30 |
35 |
0 |
t1 |
② |
30 |
55 |
0 |
t2 |
③ |
5 |
20 |
0.1 |
3s |
④ |
15 |
20 |
0.1 |
1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1 t2(填“>”“=”“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是 (填实验序号),合理的结论是 。
【交流探讨】MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
Ⅱ、【探究二】探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 |
实验情况记录 |
结论 |
|
① |
|
A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 |
Fe2O3 (填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② |
将B试管中的混合物过滤,把滤渣烘干、 。 |
固体质量0.2g |
Fe2O3质量未变 |
③ |
|
C试管上方带火星的木条 , D试管中溶液变成 色 |
Fe2O3可作过氧化氢分解的催化剂 |
【得出结论】过氧化氢分解快慢受温度、浓度、催化剂等因素影响。
兴趣活动小组设计并完成了如下实验(装置气密性良好,药品足量):
| 操作 |
现象 |
结论 |
装置 |
| 实验一: 同时将Ⅰ中5mL5%的过氧化氢溶液和Ⅱ中 mL15%的过氧化氢溶液注入各盛有0.5g二氧化锰的甲、乙中,关闭弹簧夹。 |
发现烧杯中右侧导管口产生气泡的速率比左侧快。 |
化学反应速率与 有关; 该反应的化学方程式为 。 |
|
| 操作 |
现象 |
现象分析 |
装置 |
| 实验二: 先将稀盐酸注入甲,关闭弹簧夹;再将水注入乙,关闭弹簧夹。 注意:注入液体后,甲、乙导管口均处于液面以下。 |
甲中液体先流入烧杯,乙中液体后流入烧杯,然后观察到烧杯中先无明显现象,后有白色沉淀产生。 |
乙中液体流入烧杯的原因是 ; 甲中流入烧杯的液体溶质的化学式是 。 |
|
过氧化氢溶液保存时,因缓慢分解导致质量分数变小(化学方程式为2H2O2═2H2O+O2↑)。为探究酸碱性对过氧化氢分解快慢的影响,小明利用图甲装置,每次实验往锥形瓶中加10克30%过氧化氢溶液,再滴加调节剂,使其pH分别从3依次调至13,在60℃反应温度下进行实验,获得数据如图乙。
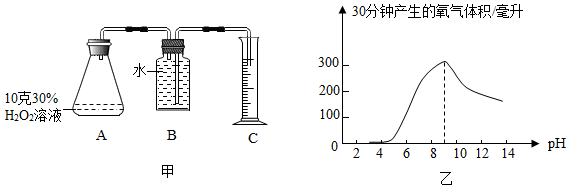
(1)氧气能用排水法收集,是因为 。
(2)根据本实验结果,对实验室常温保存过氧化氢溶液提出合理的建议: 。
(3)某次实验中,当10克溶质质量分数为30%的过氧化氢溶液分解产生0.32克氧气时,剩余过氧化氢溶液的溶质质量分数为多少?(滴加的试剂对溶液质量的影响忽略不计,计算结果精确到1%)
某实验小组探究了溶质的质量分数对H 2O 2分解速率的影响。实验装置如图1所示,用注射器加入不同浓度的H 2O 2溶液(见下表),实验中使用传感器装置测算生成O 2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图2所示。

| 实验编号 | H 2O 2的质量分数(%) | H 2O 2溶液的体积(mL) | 对应曲线 |
| Ⅰ | 3.4 | 10.0 | a |
| Ⅱ | 2.4 | 10.0 | b |
| Ⅲ | 1.7 | 10.0 | c(待绘制) |
(1)实验前需准备不同浓度的H 2O 2溶液,若要配制100.0g质量分数为2.4%的H 2O 2溶液,需质量分数为30%的H 2O 2溶液 g。
(2)根据实验探究目的,从曲线a、b中,可得出的结论是 。
(3)计算实验Ⅰ条件下H 2O 2完全分解所得氧气的质量,并写出具体计算过程(1.5﹣5.0% H2O2溶液的密度取值1.0g/mL)。
(4)在如图2中画出曲线c的大致位置及趋势。