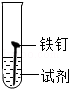
实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为 (填字母),用玻璃棒引流,并不断搅拌。
A.将浓硫酸缓缓注入盛有水的烧杯中
B.将水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为 。
(3)图1所示的仪器B、D的名称为 、 ,组装制取H2的发生装置应选用的仪器为 (填字母)。
(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的 。
(5)相同条件下H2密度比空气小,利用该性质可以通过 法收集H2,若用图2所示装置测量生成H2的体积,H2应从 (填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mL H2(通常状况)所需的时间,下表为实验数据:
实验编号 |
硫酸的质量分数/% |
硫酸的体积/mL |
锌粒的质量/g |
时间/s |
1 |
10 |
10 |
1 |
78 |
2 |
10 |
10 |
2 |
57 |
3 |
40 |
10 |
1 |
9 |
①比较实验1、2的数据,可以得出的结论是 。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是 。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是 (写出一种)。
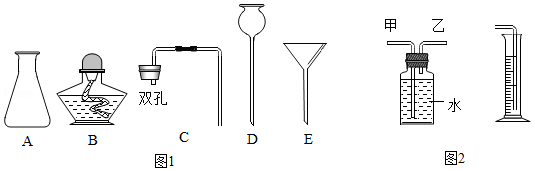
金属与酸反应属于放热反应,其反应速率除受反应物的性质影响外,还受温度、酸的质量分数、固体表面积大小等因素影响。现探究酸质量分数对反应速率的影响,实验室提供秒表、图甲器材和颗粒均匀的锌粒、铁片、铜片、2%稀盐酸、4%稀盐酸、2%稀硫酸、碎冰、水等药品。
(1)请选择合适器材和药品,设计实验写出步骤(可配图说明)。
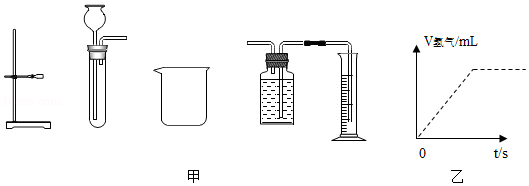
(2)实验结论:其他条件都相同时,酸的质量分数越大,反应越快。图乙是某资料中铁与2%稀硫酸在恒温条件下,生成氢气体积随时间变化的图象。请根据实验结论,对曲线进行适当的修改(在答题纸图乙上用实线画出),使其更合理。
实验室常用高锰酸钾制取氧气,可能用到的装置如图所示。
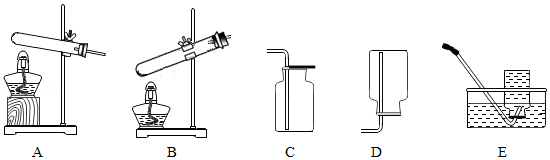
(1)本实验可选用的发生和收集装置为 (填字母)。
(2)①写出高锰酸钾分解制氧气的化学方程式: 。
②上述反应的理论产氧率为 [产氧率 100%,结果精确到0.1%]。
③取一定量的高锰酸钾固体,充分加热,发现实际产氧率远高于上述数值,则可能的原因有 (测定过程中产生的误差可忽略)。
(3)某同学进行该实验并用排水法收集O2.下列操作正确的是 (填字母)
a.未检查装置气密性即向大试管中加入高锰酸钾固体
b.当导管口有连续气泡均匀冒出时,开始收集氧气
c.集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
d.气体收集完毕后,先熄灭酒精灯,再将导管移出水面
(4)实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10%的双氧水(其他实验条件均相同),测定收集500mL氧气所用的时间,结果如表:
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
MnO2用量/g |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
所用时间/s |
17 |
8 |
6 |
3 |
2 |
2 |
2 |
2 |
2 |
①写出上述反应的化学方程式: 。
②该实验可得出的结论是 。
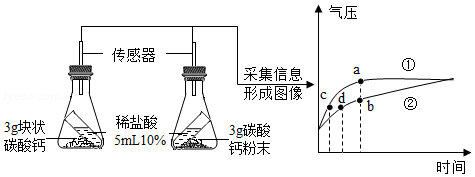
利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。某同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测得瓶内气压随时间的变化如图所示。
(1)碳酸钙与稀盐酸反应的化学方程式 。
(2)下列有关说法正确的是 (填字母序号)。
A.对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸反应
B.对比分析c、d点可知,相同的气压时,碳酸钙粉末与稀盐酸反应速率更快
C.碳酸钙粉末产生的CO2质量多
小明进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题。
(1)MnO2作催化剂向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。

①写出用H2O2溶液制备O2的化学方程式: 。
②用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为 B → → E (填标号)。为了确保实验成功,在装药品之前应该 。
③检验O2的方法是 ,若木条复燃,则证明收集的气体为O2。
(2)FeCl3溶液做催化剂
向5mL5%的H2O2溶液中加入2滴一定浓度的 FeCl3溶液,立即产生大量气泡。
[已知]FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl﹣
[问题]那种微粒对H2O2溶液的分解起催化作用?
[假设]假设一:可能是H2O
假设二:可能是Fe3+
假设三:可能是Cl﹣
[解析]①假设一不可能成立,理由是 。
[实验]
操作 |
现象 |
其他条件不变,向H2O2溶液中加入NaCl溶液 |
无明显变化 |
其他条件不变,向H2O2溶液中加入Na2SO4溶液 |
无明显变化 |
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液 |
立即产生大量气泡 |
[结论]②假设 成立,而假设一和另一种假设不成立。
(3)催化剂比较
从循环利用的角度分析, (填化学式)更适合做该反应的催化剂。
某兴趣小组对KClO 3分解反应的催化剂进行研究,在相同的加热条件下,用如图装置完成表中实验:
| 编号 |
KClO 3质量/g |
催化剂 |
催化剂质量/g |
收集50mLO 2所需时间/s |
| 实验1 |
5 |
﹣ |
﹣ |
171 |
| 实验2 |
5 |
MnO 2 |
0.5 |
49 |
| 实验3 |
5 |
Fe 2O 3 |
0.5 |
58 |
| 实验4 |
5 |
KCl |
0.5 |
154 |
(1)设置实验1的目的是 。
(2)表中所列3种催化剂的催化效果最佳的是 。
(3)写出KClO 3分解的化学方程式: 。
(4)由实验1和实验4可知,KCl (填"有"或"无")催化作用。维持加热条件不变,用实验1再继续收集50mLO 2,所需时间明显少于171s,解释原因: 。
(5)要比较KClO 3分解反应中不同催化剂的催化效果,除了测量收集50mLO 2所需时间外,还可以测量相同时间内 。

某研究小组为探究"影响铁制品锈蚀快慢的因素",取同浓度的稀氨水和稀醋酸用下图装置完成表中实验,回答下列问题。
| 实验序号 |
① |
② |
③ |
④ |
| 实验温度/℃ |
25 |
25 |
70 |
70 |
| 试剂 |
稀氨水 |
稀醋酸 |
稀氨水 |
稀醋酸 |
| 出现铁锈所需时间 |
1天未见锈蚀 |
5分钟 |
1天未见锈蚀 |
1分钟 |
(1)铁锈的主要成分是 (填化学式)。
(2)实验②和④可探究 因素对铁制品锈蚀快慢的影响,欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是 (填实验序号)。
(3)根据表中实验现象得出的结论是 (写出1点即可)
(4)影响铁制品锈蚀快慢除上述因素外,还有 (写出1点即可),请设计实验方案 。