某学习小组对铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关?
【查阅资料】
1.氯化钙固体可作干燥剂。
2.一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
3.常温常压,氢气密度是dg/mL。
【设计与实验】
实验一:定性探究铁锈蚀的因素
取四枚相同的洁净无锈铁钉分别放入试管,进行图1实验,现象如表1。
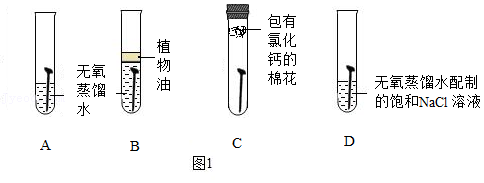
表1
试管 |
一周后现象 |
A |
铁钉表面有一层铁锈 |
B |
铁钉表面无明显变化 |
C |
铁钉表面无明显变化 |
D |
铁钉表面有较厚铁锈 |
(1)对比A、B、C试管中实验现象,说明铁锈蚀主要是与空气中的 发生化学反应。
(2)对比A、D试管中实验现象,说明铁锈蚀还与 有关。
(3)铁锈蚀后应及时除锈的原因是 。写出除铁锈的化学方程式 。
实验二:定量探究铁锈蚀的因素
小组设计了图2装置,检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上,采集数据。
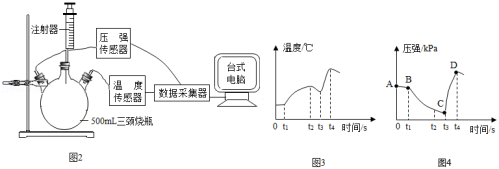
(4)据图3,t2时刻后反应并未停止温度却开始降低,原因是 。
(5)据图4,对比AB段和BC段说明 ,分析t3时刻后压强突然变大的原因是 。
实验三:测定铁锈含量
将实验二烧瓶中剩余物质过滤、洗涤、干燥,得mg固体,连接图5装置,检查气密性,加入固体与足量稀盐酸进行实验。

(6)完全反应后,常温常压下测得生成气体体积为VmL,则该固体中铁锈质量分数表达式为 。
(7)该实验条件下测得铁锈质量分数偏小的原因是 ,解决方法是 。
【反思与评价】
(8)与实验一对比,实验二铁锈蚀明显更快的原因是 。
某同学发现自己眼镜框中铜制部位表面有绿色的铜锈,他联想到探究铁生锈条件的实验,决定采用控制变量法探究铜生锈的原因,请你一起探究。
【提出问题】铜生锈的原因是什么?
【查阅资料】铜锈的主要成分是Cu2(OH)2CO3,俗称铜绿。
【猜想与假设】根据查阅的资料猜测:铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果,理由是 。
【设计与实验】他仿照探究铁生锈条件的实验,设计并进行了如下四个实验(说明:实验中用到的蒸馏水均已煮沸过且铜片已打磨干净)。
实验编号 |
一 |
二 |
三 |
四 |
实验装置 |
|
|
|
|
实验现象 |
铜片不生锈 |
铜片不生锈 |
铜片不生锈 |
铜片生锈 |
在上述实验三中,控制的因素是 ,制取氧气的方法与加热高锰酸钾制取氧气的方法相比具有的优点是 (写一条)。铜生成铜绿的化学方程式为 。
【实验结论】他的猜想正确。
【反思与提高】
(1)生活中你会发现厨房中的铁锅与水接触的部分最容易生锈,切开的苹果不久后变成咖啡色,好像生了“锈”。这些物质“生锈”除了与水有关外,都与 (填物质名称)有关。
(2)请你提出一条延长食品保质期的建议: 。
(3)要除去眼镜框表面的铜绿,应选用的药品是 (写一种)。
久置的铜制品表面能生成绿色的铜锈[主要成分为Cu 2(OH) 2CO 3],某化学兴趣小组对铜生锈的条件进行了以下探究.
【提出猜想】根据铜锈的组成元素推测,铜生锈可能是铜与空气中的二氧化碳、水等物质反应的结果.
【实验设计】兴趣小组同学取打磨光量的铜丝,设计了如图所示的四个实验.

【现象分析】若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶中的铜丝均无铜锈出现.
(1)实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是 .
(2)B瓶与D瓶中的现象对比,可以得出的结论是 .
【实验结论】由上述四个实验可分析得出,铜生锈是铜与空气中的 共同作用的结果.
【拓展探究】以锈蚀严重的废铜屑为原料,回收制取纯铜.
查阅资料:Cu 2(OH) 2CO 3+2H 2SO 4═2CuSO 4+3H 2O+CO 2↑
Cu 2(OH) 2CO 3  2CuO+H 2O+CO 2↑
2CuO+H 2O+CO 2↑
如图是该兴趣小组设计的两种回收铜的实验方案:

【分析评价】①步骤Ⅱ反应过程中发生了还原反应的物质是 (填化学式).
②步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是 .
③步骤Ⅴ过程发生反应的化学方程式为 .
④同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一 (填">"或"="或"<")方案二.以上两种方案中,方案二优越于方案一,理由是 (任答一点).
小金为探究铁制品锈蚀的条件,进行如下实验:
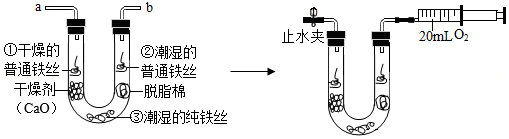
步骤1:利用图甲所示装置,将干燥的O 2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O 2后,在导管b处连接一活塞推至底部的注射器收集20mLO 2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形管内的铁丝其现象如表所示。
| 观察对象 |
现象 |
| ①干燥的普通铁丝 |
没有明显变化 |
| ②潮湿的普通铁丝 |
较多红褐色锈斑 |
| ③潮湿的纯铁丝 |
没有明显变化 |
(1)步骤1中,检查U形管内是否已充满O 2的方法是 。
(2)铁制品锈蚀的条件之一是需要 O 2,在此实验中能支持此条件的证据是 。
(3)通过对比实验现象,此实验还可得出铁制品锈蚀的条件是 。