某校化学兴趣小组的同学发现长期露置在空气中的金属M表面会被锈蚀,于是他们一起探究金属M锈蚀的原因。经检测,锈蚀物中除含有M元素外,还含有C、H、O三种元素。
(1)甲同学依据锈蚀物中的组成元素,推测空气中 肯定参加了反应,但不能确定空气中的氧气是否参与反应。为了确认空气中的氧气是否参加反应,设计如图系列实验,你认为其中必须要做的对照实验是 (填字号)。
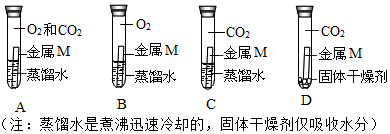
若观察到 (填现象),证明氧气参加了反应。
(2)若金属M是铜,铜器具长期露置在空气中会生成绿色铜锈,它的主要成分是碱式碳酸铜(Cu2(OH)2CO3)。小组同学欲探究Cu2(OH)2CO3的性质。
查阅资料:①Cu2(OH)2CO3的化学性质与Cu(OH)2和CuCO3混合物的性质相同
②Cu(OH)2受热分解生成CuO和H2O,CuCO3的化学性质和CaCO3相似
③白色CuSO4粉末遇水变蓝色
结合以上信息分析Cu2(OH)2CO3加热分解产物为 。
[实验探究]
为进一步验证Cu2(OH)2CO3受热分解产物,从如图中选择部分装置进行实验。装置的连接顺序为 ;实验中可观察到的现象是 。

[实验结论]碱式碳酸铜受热易分解。
钢铁的腐蚀是重要研究课题。
[知识回顾]用如图1所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。

(1)由A、B、C的现象可知,铁的锈蚀是铁跟 (填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是 。
[实验探究]向试管D中(含生锈铁钉)加入过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式: 。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如表3个实验(持续10小时,已知氢气不影响该反应)
序号 |
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
实验内容 |
|
|
|
现象 |
溶液颜色始终呈黄色 |
产生红褐色沉淀 |
溶液逐渐由黄色变浅绿色 |
①设计实验Ⅰ的目的是 。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是 。
[拓展延伸]研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。

(5)图2表示水样温度22℃、氧含量6mL•L﹣1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是 。
(6)图3表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL•L﹣1时,钢铁腐蚀速率明显下降的原因可能是 。
铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验:
步骤1:利用如 图所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹k1、k2夹紧。
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:
(1)步骤1中,检验U形管内已充满O2的方法是 。
(2)步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有 (填化学式),②处可能观察到的现象是 ,③处没有明显变化,说明纯铁的抗腐蚀能力较 (填“强”或“弱”)。
(3)待U形管内有明显现象后,将b导管插入水中,打开止水夹k2,观察到 现象,说明该条件下铁制品锈蚀过程消耗了O2。
(4)通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁): 。

"对比实验"是科学探究常用的方法,根据下列所示的实验示意图回答问题。

(1)实验1中,将大小相同的滤纸片和乒乓球碎片放在薄铜片的两侧,加热铜片的中部,观察现象。通过此实验,可说明燃烧的条件之一的是 (填序号)。
A.可燃物 B.空气 C.温度达到着火点
(2)实验2中,把干燥的紫色纸花和湿润的紫色石蕊纸花分别伸入两瓶干燥的二氧化碳气体中,下列有关说法正确的是 (填序号)。
A.CO 2与水发生了反应 B.水具有酸性
C.干燥的紫色石蕊纸花变红 D.湿润的紫色石蕊纸花变红
(3)实验3是探究铁钉锈蚀条件的实验,会出现明显现象的是试管 (填序号),说明铁生锈实际上是铁与 发生反应。