某同学发现自己眼镜框中铜制部位表面有绿色的铜锈,他联想到探究铁生锈条件的实验,决定采用控制变量法探究铜生锈的原因,请你一起探究。
【提出问题】铜生锈的原因是什么?
【查阅资料】铜锈的主要成分是Cu2(OH)2CO3,俗称铜绿。
【猜想与假设】根据查阅的资料猜测:铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果,理由是 。
【设计与实验】他仿照探究铁生锈条件的实验,设计并进行了如下四个实验(说明:实验中用到的蒸馏水均已煮沸过且铜片已打磨干净)。
实验编号 |
一 |
二 |
三 |
四 |
实验装置 |
|
|
|
|
实验现象 |
铜片不生锈 |
铜片不生锈 |
铜片不生锈 |
铜片生锈 |
在上述实验三中,控制的因素是 ,制取氧气的方法与加热高锰酸钾制取氧气的方法相比具有的优点是 (写一条)。铜生成铜绿的化学方程式为 。
【实验结论】他的猜想正确。
【反思与提高】
(1)生活中你会发现厨房中的铁锅与水接触的部分最容易生锈,切开的苹果不久后变成咖啡色,好像生了“锈”。这些物质“生锈”除了与水有关外,都与 (填物质名称)有关。
(2)请你提出一条延长食品保质期的建议: 。
(3)要除去眼镜框表面的铜绿,应选用的药品是 (写一种)。
利用铁粉、炭粉、氯化钠进行铁的锈蚀实验(装置如图所示,装置气密性良好)。实验1min后温度计读数上升,8min后打开止水夹,水倒吸入锥形瓶。实验数据如下表:
| 实验前的体积 |
实验后的体积 |
|
| 锥形瓶内空气(含导管内空气) |
烧杯内水 |
烧杯内剩余水 |
| 246.0mL |
100.0mL |
51.5mL |
下列说法不合理的是( )
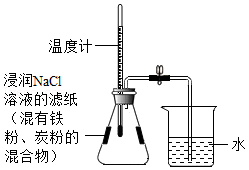
| A. |
铁的锈蚀是放热反应 |
| B. |
使用氯化钠溶液的目的是加快铁的锈蚀 |
| C. |
此实验能推断出铁的锈蚀需要水的参与 |
| D. |
计算得出空气中氧气的含量约为19.7% |
如图是探究铁钉锈蚀条件的4个实验,一段时间后观察现象。下列说法不正确的是( )
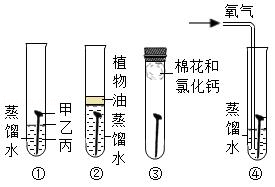
| A. |
①中甲、乙、丙三处比较,生锈最明显的地方是甲 |
| B. |
①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水 |
| C. |
③中附着在棉花上的氯化钙的作用是作干燥剂 |
| D. |
四个实验中,生锈最快的是④中的铁钉 |
某校化学兴趣小组的同学发现长期露置在空气中的金属M表面会被锈蚀,于是他们一起探究金属M锈蚀的原因。经检测,锈蚀物中除含有M元素外,还含有C、H、O三种元素。
(1)甲同学依据锈蚀物中的组成元素,推测空气中 肯定参加了反应,但不能确定空气中的氧气是否参与反应。为了确认空气中的氧气是否参加反应,设计如图系列实验,你认为其中必须要做的对照实验是 (填字号)。
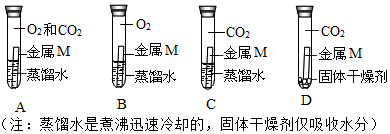
若观察到 (填现象),证明氧气参加了反应。
(2)若金属M是铜,铜器具长期露置在空气中会生成绿色铜锈,它的主要成分是碱式碳酸铜(Cu2(OH)2CO3)。小组同学欲探究Cu2(OH)2CO3的性质。
查阅资料:①Cu2(OH)2CO3的化学性质与Cu(OH)2和CuCO3混合物的性质相同
②Cu(OH)2受热分解生成CuO和H2O,CuCO3的化学性质和CaCO3相似
③白色CuSO4粉末遇水变蓝色
结合以上信息分析Cu2(OH)2CO3加热分解产物为 。
[实验探究]
为进一步验证Cu2(OH)2CO3受热分解产物,从如图中选择部分装置进行实验。装置的连接顺序为 ;实验中可观察到的现象是 。

[实验结论]碱式碳酸铜受热易分解。
掌握科学的研究方法,探索化学世界的奥秘。
(1)实验是学习化学的重要途径,对比法是一种常用的实验方法。请完成下列实验中的问题:
实验一:探究燃烧的条件

如图所示,为证明燃烧需要可燃物,可用玻璃棒分别蘸取蒸馏水和 ,置于酒精灯火焰上,观察现象。
实验二:探究铁锈蚀的条件

①试管 (填字母)中的铁钉生锈。
②通过对比试管B、C中的现象,可以得出铁生锈需要与 接触。
(2)在"宏观一微观一符号"之间建立联系,是学习化学特有的思维方式。一氧化碳燃烧的微观模拟示意图如图所示:

依据图中所给信息,回答下列问题:
①写出该反应的化学方程式: ,其基本反应类型是 。
②从微观角度分析
a.CO和CO 2的组成元素相同,但化学性质不同,其原因是 。
b.化学反应前后 不变(写一点)。
(3)比较与归纳是学习化学的重要方法。由碳、氢元素组成的物质种类繁多,烷烃就是其中一类重要的物质,下表列出了烷烃的一些信息。
| 名称 |
甲烷 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
己烷 |
…… |
| 化学式 |
CH 4 |
C 2H 6 |
C 3H 8 |
C 4H 10 |
C 5H 12 |
C 6H 14 |
…… |
| 碳元素的质量分数 |
75.0% |
80.0% |
81.8% |
82.8% |
83.3% |
83.7% |
…… |
| 1g物质完全燃烧消耗氧气的质量/g |
4.00 |
3.73 |
3.64 |
3.59 |
3.56 |
3.53 |
…… |
分析表中数据,我们可以总结出一些与烷烃相关的变化规律,写出其中的两条:
①随着烷烃分子中碳原子数的增加,碳元素的质量分数逐渐 (填"增大"或"减小")。
② 。
某小组同学在探究铁生锈的条件时,将铁钉浸没在试管里的食盐水中,一段时间后,发现试管底部出现了黑色粉末。该小组同学对此黑色粉末进行了如下探究。
[提出问题]试管中黑色粉末的成分是什么呢?
[猜想与假设]猜想①Fe 猜想②Fe2O3猜想③Fe3O4猜想④FeCl3
[查阅资料]Fe3O4是黑色晶体,能被磁铁吸引。
[分析讨论]
你认为上述四个猜想中,不做实验就可排除的是猜想 和猜想 ,理由是 、 。
[实验探究]
(1)将试管中黑色粉末干燥后,用磁铁靠近,发现黑色粉末能被磁铁吸引,于是得出结论,黑色粉末一定是Fe,你认为该结论正确吗? (填“正确”或“不正确”),理由是 。
(2)请你设计一个实验方案,用化学方法验证黑色粉末是否为Fe。
实验操作 |
实验现象及结论 |
取 ,加入 。 |
如果有 ,则黑色粉末是Fe。 如果没有 。 |
线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如图所示实验,探究铁生锈的条件。下列说法错误的是( )
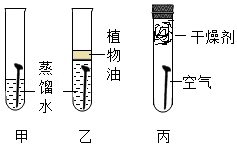
A.乙试管中植物油的作用是隔绝空气
B.只有甲试管中的铁钉有明显锈迹
C.乙丙两支试管的实验现象说明铁生锈需要水
D.实验表明铁生锈是铁与空气和水共同作用的结果
小林学习金属的相关知识后,关注到生活中有以下现象:
Ⅰ.海边的铁制品,锈蚀程度比其他地方更严重。
Ⅱ.切过咸菜的菜刀,不及时清洗,很容易就锈蚀了。
针对Ⅰ和Ⅱ的现象,小林结合学习内容查阅了相关资料并进行实验探究。
[资料卡片]
探究铁生锈的条件
编号 |
① |
② |
③ |
实验 |
|
|
|
现象 |
7天后,铁钉表面没有变化 |
2天后,铁钉表面出现红色 |
1天后,铁钉表面出现红色 |
[家庭小实验]
为了探究食盐水对铁钉锈蚀速率的影响,小林设计并完成了如图的家庭小实验,很快看到实验现象。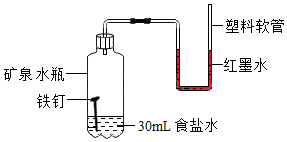
(1)该实验中红墨水液面可能出现的现象是 (填序号);
A.两端仍持平
B.左高右低
C.左低右高
你选择的理由是 。
(2)小红认为小林的实验不足以说明食盐水能加速铁钉的锈蚀,请在小林实验的基础上完善此实验方案 ;
(3)结合资料及实验结果,解释现象Ⅰ和Ⅱ 。
根据如图装置回答问题。
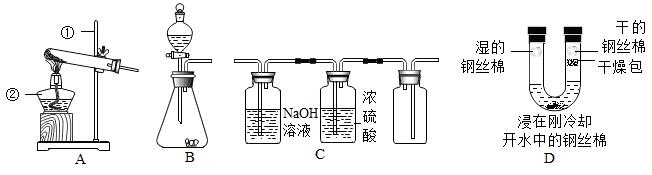
(1)写出标号仪器的名称:① ,② 。
(2)实验室用装置B制取氧气的化学方程式为 。
(3)下列混合气体(括号内气体为杂质)能用装置C进行除杂、干燥、收集的是 (填序号)。
①O2(CO2)
②CO2(HCl)
③NH3(O2)
④H2(HCl)
(4)利用装置D进行实验探究得出铁生锈的条件是 ;若U形管水中的钢丝棉也产生少量锈迹,说明该实验还需改进,你的改进方法是 。
金属防腐是科学研究中的重大课题。某校学习小组以铁的腐蚀为项目进行如下研究。
[认识铁的腐蚀]
(1)下列环境中的铁制品最容易生锈的是 (填字母序号)。
A.未擦干的铁锅 B.涂油漆的栏杆 C.盛水的不锈钢水杯
(2)铁锈的主要成分是Fe2O3•xH2O,其中铁元素的化合价是 。
[探究铁的腐蚀]
(3)该小组用如图甲装置进行实验,起始时量筒内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约 (填“40”或“10”)mL刻度处,原因是 。
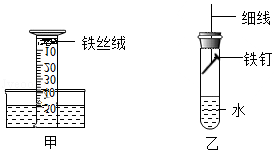
[拓展探究]
(4)小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按如图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
铁钉质量增加/g |
0.02 |
0.04 |
0.08 |
0.16 |
0.18 |
0.18 |
0.18 |
小强同学的实验是探究 因素对铁钉腐蚀快慢的影响,结论是 。
注意:若答对第(5)小题奖励3分,化学试卷总分不超过40分。
(5)有同学认为小强的实验未能真实反映50℃以后铁钉腐蚀的快慢,理由是50℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因: ;改进实验方案证明你的分析: 。
如图是初中化学教科书中的一些实验装置示意图。回答下列问题:
(1)A实验中,一段时间后可根据观察到 的现象,得出铁生锈需要与氧气接触的结论;
(2)B实验中,观察到薄铜片上的乒乓球碎片先燃烧,滤纸碎片后燃烧,可以说明燃烧条件之一是 ;
(3)C实验可得到的结论是 ;
(4)D实验中,向水中加少量硫酸钠或氢氧化钠的目的是 。
久置的铜制品表面能生成绿色的铜锈[主要成分为Cu 2(OH) 2CO 3],某化学兴趣小组对铜生锈的条件进行了以下探究.
【提出猜想】根据铜锈的组成元素推测,铜生锈可能是铜与空气中的二氧化碳、水等物质反应的结果.
【实验设计】兴趣小组同学取打磨光量的铜丝,设计了如图所示的四个实验.

【现象分析】若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶中的铜丝均无铜锈出现.
(1)实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是 .
(2)B瓶与D瓶中的现象对比,可以得出的结论是 .
【实验结论】由上述四个实验可分析得出,铜生锈是铜与空气中的 共同作用的结果.
【拓展探究】以锈蚀严重的废铜屑为原料,回收制取纯铜.
查阅资料:Cu 2(OH) 2CO 3+2H 2SO 4═2CuSO 4+3H 2O+CO 2↑
Cu 2(OH) 2CO 3  2CuO+H 2O+CO 2↑
2CuO+H 2O+CO 2↑
如图是该兴趣小组设计的两种回收铜的实验方案:

【分析评价】①步骤Ⅱ反应过程中发生了还原反应的物质是 (填化学式).
②步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是 .
③步骤Ⅴ过程发生反应的化学方程式为 .
④同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一 (填">"或"="或"<")方案二.以上两种方案中,方案二优越于方案一,理由是 (任答一点).
铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验:
步骤1:利用如 图所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹k1、k2夹紧。
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:
(1)步骤1中,检验U形管内已充满O2的方法是 。
(2)步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有 (填化学式),②处可能观察到的现象是 ,③处没有明显变化,说明纯铁的抗腐蚀能力较 (填“强”或“弱”)。
(3)待U形管内有明显现象后,将b导管插入水中,打开止水夹k2,观察到 现象,说明该条件下铁制品锈蚀过程消耗了O2。
(4)通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁): 。

如图,通过实验探究铁钉锈蚀的条件。下列说法不正确的是( )
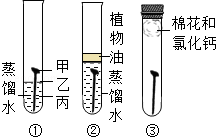
A.①中甲、乙、丙三处比较,生锈最明显的地方是丙
B.①②中使用煮沸的蒸馏水,目的是除去水中的氧气
C.②中植物油的作用是隔绝空气,③中氯化钙的作用是作干燥剂
D.①②③对比实验,得出结论:铁生锈的主要条件是与空气、水直接接触