实验桌上有一瓶敞口放置的氢氧化钠溶液,同学们对其是否变质进行实验探究。
【提出问题】敞口放置的氢氧化钠溶液是否变质呢?
【猜想与假设】
猜想Ⅰ:没有变质。
猜想Ⅱ: 。
猜想Ⅲ:部分变质。
【实验探究】
同学们分别设计了不同方案进行探究,请你协助完成相关内容。
(1)小军设计的实验方案
实验步骤 |
实验现象 |
结论 |
①取一定量的NaOH溶液于试管中,滴加无色酚酞溶液 |
溶液变成红色 |
猜想Ⅲ成立 |
②向①的试管中滴加过量的稀盐酸 |
有 产生 |
(2)小慧设计的实验方案
实验步骤 |
实验现象 |
结论 |
①取一定量的NaOH溶液于试管中,滴加过量的BaCl2溶液 |
有白色沉淀产生 |
猜想Ⅲ成立 |
②实验①结束后进行过滤,向得到的滤液中滴加 。 |
溶液变成蓝色 |
【反思与评价】
(3)同学们讨论认为,小军的实验结论不严密,理由是 。
【拓展实验】
(4)小慧实验②中所加的试剂替换为下列 操作,也可以实现相同的目的。
a.测溶液的pH
b.滴加MgSO4溶液
c.通入CO2
d.滴加稀盐酸
(5)若要除去NaOH溶液中混有的Na2CO3,涉及反应的化学方程式为 。
达州市九年级学生在5月份进行了实验操作考试,某实验室的老师准备实验药品时发现一瓶氢氧化钠固体未盖瓶塞。对于该固体是否变质,老师让三位同学通过实验来探究:
【提出问题】氢氧化钠是否变质?变质程度如何?
【猜想与假设】
猜想Ⅰ:没有变质,全部是NaOH;
猜想Ⅱ:部分变质,固体是NaOH和Na2CO3;
猜想Ⅲ:全部变质,全部是Na2CO3。
氢氧化钠变质的原因 (用化学方程式表示)。
【设计并进行实验】取一定量的固体溶于水配制成溶液,分成三份,三位同学按照自己的方案进行以下实验:
实验操作 |
实验现象 |
实验结论 |
|
小李 |
向第一份溶液中加入无色酚酞试液 |
溶液变红 |
猜想Ⅰ成立 |
小王 |
向第二份溶液中滴加几滴稀盐酸 |
无明显现象 |
猜想Ⅰ成立 |
小陈 |
向第三份溶液中加入CaCl2溶液 |
|
猜想Ⅲ成立 |
【分析讨论】
①小王和小陈认为碳酸钠溶液也能使无色酚酞试液变红,因此小李的结论不正确。
②经过讨论他们认为通过小王的实验不能得出样品中一定不含Na2CO3,原因是 。
【得出结论】综合三位同学的实验操作和现象可以得出猜想 成立。
实验结束后大家将废液倒入同一个废液缸内观察到废液呈红色,且有白色沉淀。为了不污染环境,他们向废液缸里加入一定量的稀盐酸后得到无色澄清溶液,所得溶液中溶质(酚酞除外)种类最多时,溶液中所含有的离子有 (填离子符号)。
【反思与拓展】
(1)大家一致认为实验室的NaOH必须密封保存。
(2)已知:①Na2CO3+CO2+H2O═2NaHCO3
②NaHCO3+NaOH═Na2CO3+H2O
如果向NaOH溶液中通入一定量的CO2气体,反应后所得溶液中溶质的组成有 种情况(不考虑CO2和H2CO3作溶质)。
兴趣小组的同学为探究在空气中久置的某氢氧化钠样品是否变质,设计了如图所示的A、B、C、D四组探究实验。
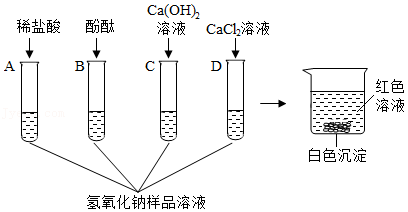
【查阅资料】氯化钙、氯化钡溶液都呈中性。
【实验探究】取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示。
【分析与结论】(1)上述四组实验中不能达到实验目的的是 (填字母序号)。
(2)实验A中,观察到 的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是 。
【继续探究】实验结束后,同学们将四支试管中反应后的混合物全部倒入一个洁净的大烧杯中(如图),充分搅拌、静置,观察到烧杯内上层清液呈红色,下层有白色沉淀。
【提出问题】上层清液呈红色,说明溶液呈碱性。上层清液中呈碱性的物质是什么?
【猜想与假设】上层清液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种或两种。
【设计实验】取少量烧杯中的上层清液于试管中,加入过量的氯化钡溶液,观察现象。
【现象与结论】
预测现象 |
结论 |
①若有白色沉淀生成,溶液呈红色 |
上层清液中呈碱性的物质是
|
②若无沉淀生成,溶液呈红色 |
上层清液中呈碱性的物质是氢氧化钙。 |
【实验反思】同学们认为上述预测现象②所得结论不严密,原因是 。