(1)如图1为实验室制取并收集气体的装置图,请回答下列问题。
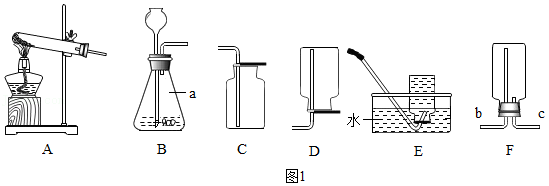
①仪器a的名称是 。
②若用A装置制取氧气,写出对应的化学方程式 。
③若需收集一瓶较纯净的氧气,应选用的装置是 (填装置序号)。
④若用C装置收集一瓶二氧化碳气体,其验满的方法是 。
⑤二氧化硫是一种有刺激性气味的有毒气体,比空气的密度大,易溶于水且与水反应。若用F装置收集二氧化硫气体,则气体应从 (填“b”或“c”)端导入。
(2)电解饱和食盐水可以制得氢氧化钠、氯气(Cl2)和氢气,并进而生产具有消毒、漂白作用的漂白液。
①粗盐中的难溶性杂质可通过溶解、 操作除去,以免破坏电解装置。
②写出电解饱和食盐水的化学方程式 。
③某同学想知道某一瓶放置一段时间的漂白液是否变质,设计了下列探究实验。
【查阅资料】
Ⅰ.制取漂白液(有效成分为NaClO)的原理:Cl2+2NaOH═NaCl+NaClO+H2O;
Ⅱ.在空气中NaClO易发生反应:2NaClO+H2O+CO2═Na2CO3+2HClO,HClO能使有色布条褪色,且HClO含量越高,漂白效果越好;HClO易分解,分解后丧失漂白作用;
Ⅲ.Ca(ClO)2易溶于水。
【提出问题】放置一段时间的漂白液是否变质?
【提出猜想】
猜想1:未变质,溶液中主要成分为NaCl、NaClO
猜想2:部分变质,溶液中主要成分为NaCl、NaClO、Na2CO3
猜想3:全部变质,溶液中主要成分为NaCl、Na2CO3
【实验探究】
实验操作 |
实验现象 |
实验结论 |
ⅰ取适量该溶液于烧杯中,放入有色布条 |
|
猜想3不成立 |
ⅱ另取适量该溶液于试管中,滴入适量氯化钙溶液 |
产生白色沉淀 |
猜想 成立 |
写出实验操作ii中产生白色沉淀的化学方程式 。
【拓展应用】由【查阅资料】和图2可知,需控制pH约为 时(填整数),漂白液具有最佳漂白能力。

实验室有一瓶配制数天的Na 2SO 3溶液,现在对其成分进行检测:
【成分猜想】猜想一:只有Na 2SO 3;
猜想二: ;
猜想三:既有Na 2SO 3,也有Na 2SO 4。
【查阅资料】①Na 2SO 3易被空气中的氧气氧化生成Na 2SO 4.②BaSO 4
不溶于稀盐酸和稀硫酸。③Na 2SO 3和盐酸、硫酸反应均生成SO 2。
【方案设计】
| 方案 |
实验操作 |
实验现象 |
结论 |
| 一 |
①加入足量的稀盐酸 ②再加入足量的BaCl 2溶液 |
|
猜想三正确 |
| 二 |
①加入足 ②再加入足量的BaCl 2溶液 |
有气体和白色沉淀生成 |
猜想一或猜想三正确 |
【方案分析】
(1)方案一中的实验现象为 ;方案一中加入BaCl 2溶液后发生反应的化学方程式为 。
(2)方案二的设计是否合理: (填"合理"或"不合理");若不合理。理由是 。
【实验结论】通过分析比较,方案设计 (填"一"或"二")合理。
小明在实验室发现一瓶未密封的KOH固体,对其成分进行实验探究。
【查阅资料】:①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是 。
②K 2CO 3溶液呈碱性,CaCl 2溶液,KCl溶液呈中性。
【猜想假设】:假设I:只含KOH;假设II:含KOH和K 2CO 3;假设III:只含K 2CO 3。
【进行实验】
| 实验操作步骤 |
实验现象 |
实验结论 |
| (1)取少量样品于试管中,加入足量的稀盐酸 |
有气泡 产生 |
假设 不正确 |
| (2)另取少量样品于试管中,加水溶解,加入过量的CaCl 2溶液,振荡,静置 |
|
猜想II正确 |
| (3)取②中上层清液,滴加无色的酚酞试液 |
|
【拓展应用】:完全变质的KOH也有利用价值,从K 2CO 3的组成或性质看,K 2CO 3在农业上的用途是 (填一种即可)。
实验室一瓶久置的氢氧化钠溶液可能发生了变质(若发生变质,变质结果是生成了Na2CO3)。现对该瓶氢氧化钠溶液进行分析检测。
[猜测溶质]猜测一:溶液中溶质只有NaOH;
猜测二:溶液中溶质只有Na2CO3;
猜测三:溶液中溶质 。
[查阅资料]①溶液能使无色酚酞变红,则该溶液可能是碱溶液或碱性溶液。
②Na2CO3溶液能使pH试纸变蓝,BaCl2溶液则不能使pH试纸变色。
[实验设计]

[实验结论]
根据实验方案一,你得出的结论是:溶液中的溶质一定有 ,可排除猜测 。
根据实验方案二,你认为该瓶溶液中的溶质是 。
[讨论]
(1)实验方案一不能准确确定溶质一定含有NaOH的原因是 。
(2)实验室为防止NaOH溶液变质,你的措施是 。(答一点即可)
化学实验室常取用氢氧化钠溶液,当多次揭开其瓶盖后,同学们猜想该试剂可能变质了,在征得老师同意后,开展了以下探究:
【提出问题1】该瓶氢氧化钠溶液是否变质了呢?
【实验探究1】
实验操作 |
实验现象 |
化学方程式 |
实验结论 |
取少量该溶液于试管中,滴加几滴稀盐酸 |
有气泡产生 |
|
氢氧化钠溶液一定变质了 |
NaOH溶液变质的原因 (用化学方程式表示)
【提出问题2】该瓶氢氧化钠溶液是全部变质还是部分变质呢?
【查阅资料】氯化钙溶液、氯化钠溶液均呈中性,碳酸钠溶液呈碱性.
【实验探究2】
实验操作 |
实验现象 |
实验结论 |
①取少量该溶液于试管中加水溶解,滴加过量的CaCl2溶液,并不断振荡 |
|
说明原溶液中一定含有Na2CO3 |
② ,滴加酚酞溶液 |
溶液变为红色 |
说明原溶液中一定还含有NaOH |
【实验结论】该氢氧化钠溶液 (填“部分”或“全部”)变质.
【反思与评价】
(1)在上述【实验探究2】中,甲提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”),原因是 (用化学方程式表示).
(2)若将【实验探究2】中加入的酚酞溶液换为某盐溶液,会产生与中不同的实验现象,也可得出中相同的结论.写出一种符合条件的盐的化学式 .
【理解与应用】氢氧化钠溶液容易变质,必须密封保存,用后应立即盖上瓶盖.
某学校化学兴趣小组同学在实验室发现一瓶忘了盖瓶盖的NaOH固体,对其成分是否变质以及变质程度产生了兴趣.同学们作出了以下猜想,并进行如下实验探究.
【提出问题】这瓶NaOH固体样品的成分是什么呢?
【作出猜想】猜想1:只含NaOH 猜想2:只含Na 2CO 3 猜想3:含有NaOH和Na 2CO 3
【讨论交流】NaOH可能变质的原因是 (用化学方程式表示)
【实验探究】(1)取少量样品于试管中,加入足量稀盐酸,有气泡产生,说明猜想 不成立.
(2)进一步他探究过程如下:
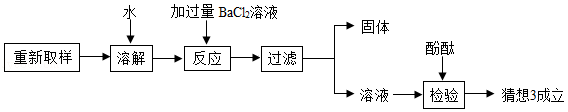
根据上述探究过程回答:
①加入过量BaCl 2溶液的作用是 ;
②不能用适量Ba(OH) 2溶液代替过量的BaCl 2溶液的原因是 ;
③下列溶液可用来代替酚酞试液检验猜想3成立的是 .
| A. |
CuCl 2溶液 |
B. |
KNO 3溶液 |
C. |
CaCl 2溶液 |
D. |
NH 4Cl溶液 |
【实验反思】实验室里,NaOH固体的保存方法是 .