为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl 2溶液呈中性)

(1)小柯认为"甲图实验说明了氢氧化钠固体部分变质"。你认为小柯的观点是否正确,并说明理由 。
(2)分析乙图实验的现象,可以确定样品的变质情况为 。
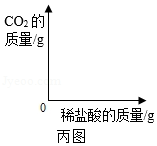
(3)进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中画出"生成CO 2的质量随加入稀盐酸质量变化"的大致图象 。
小科同学对实验中已经变质的氢氧化钠固体进行探究
【提出问题】氢氧化钠是否完全变质?
【猜想与假设】
①部分变质,固体是NaOH和Na 2CO 3的混合物;
②全部变质,固体是Na 2CO 3。
【查阅资料】
①Na 2CO 3溶液与FeCl 3溶液会发生反应,有红褐色絮状沉淀等现象出现;
②NaCl溶液和BaCl 2溶液均呈中性。
【进行实验】
|
步骤 |
实验操作 |
实验现象 |
|
1 |
取少量固体于小烧杯中,加水充分溶解 |
固体全部溶解 |
|
2 |
取少量烧杯中的溶液于试管中,加入过量的 BaCl 2溶液 |
产生白色沉淀 |
|
3 |
取 于另一试管中,再加入少量FeCl 3溶液 |
产生红褐色絮状沉淀 |
【解释与结论】
(1)请将步骤3实验操作补充完整;
(2)步骤2加入过量BaCl 2溶液的目的是 ;
(3)根据实验现象,可确定该固体是NaOH和Na 2CO 3的混合物。
【交流与评价】小科同学把步骤3中的FeCl 3溶液改成无色酚酞试液,若无色酚酞试液变红,也可以确定该固体是NaOH和Na 2CO 3的混合物。你认为是否合理?
得出结论: 。
实验室有一瓶长期放置的氢氧化钠固体(如图1),某兴趣小组同学欲对该固体变质情况进行探究。

【提出问题】该瓶氢氧化钠固体是否变质,变质情况如何?
【查阅资料】①氢氧化钠在空气中容易变质但不会转化为NaHCO 3;
②CaCl 2溶液呈中性
③CaCl 2+Na 2CO 3═CaCO 3↓+2NaCl
【提出猜想】猜想Ⅰ:固体未变质
猜想Ⅱ:固体全部变质
猜想Ⅲ:固体部分变质
【原因分析】氢氧化钠在空气中变质的原因是 (用化学方程式表示)。
【进行实验】小聪同学取少量样品于烧杯中,用足量水溶解,再向溶液中滴入几滴酚酞试液,溶液变红,由此他得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是 ,为了进一步得出结论,组内其他三位同学分别取小聪实验后的溶液于试管中,进行如下表所示实验。
|
同学 |
小红 |
小美 |
小伍 |
|
实验操作 |
加入适量氢氧化钙溶液 |
加入过量氯化钙溶液 |
加入过量稀盐酸 |
【实验结论】小红、小美的实验中都观察到有白色沉淀生成且溶液仍是红色,于是他们都出猜想Ⅲ正确。
【反思评价】(一)老师指出,仅凭小红的实验操作和现象无法确定猜想Ⅲ正确,理由是 。
(二)根据小美的结论推测小实验现象是 。
【提出问题】如何测定变质的氢氧化钠固体中碳酸钠的质量分数?
【实验原理】通过测定一定质量样品与足量稀硫酸反应生成二氧化碳的体积来计算碳酸钠的质量分数。
【实验设计】小伍称取一定质量的样品,按如图2装置进行实验(已知该装置气密性良好,水准管高度可以上下调节,量气管是带有刻度的仪器)。
【反思评价】(一)在实验中,若没有植物油,测定结果会 (填"偏大"、"偏小"或"不变")。
(二)操作中,下列情况不影响测定结果的是 (填字母)。
A、实验前试管中有空气
B、实验中水准管口有水溢出
C、读数时量气管和水准管液面不相平
D、实验后生成的气体在试管中仍有滞留。
(1)如图是实验室制取气体的一些装置,据图回答:
①图B中仪器a的名称是
②用高锰酸钾制取氧气的发生装置是 (填序号),若用C装置收集氧气,验满时,应将带火星的木条放在 (填“b”或“c”)端导管口,若木条复燃,说明氧气已满。
(2)小明在帮老师整理实验室时,发现一瓶未密封的KOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究。
[查阅资料]:①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是 。
②K2CO3溶液呈碱性,BaCl2溶液、KCl溶液呈中性。
[猜想假设]:假设Ⅰ:只含KOH;假设Ⅱ:含KOH和K2CO3;假设Ⅲ:只含K2CO3
[进行实验]:
|
实验操作步骤 |
实验现象 |
实验结论 |
|
①取少量样品于试管中,加入足量的稀盐酸 |
有气泡产生 |
假设 不正确 |
|
②另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置 |
|
假设Ⅲ正确 |
|
③取②中上层清液,滴加无色酚酞溶液 |
|
[问题讨论]:步骤②中加入过量BaCl2溶液的作用是
[拓展应用]:完全变质的KOH也有利用价值,从K2CO3组成或性质看,这瓶变质的试剂在农业上的用途是 。

为探究一瓶久置的氢氧化钠溶液(原溶质质量分数16%)是否变质,同学们提出了多种方案,其中一种方案设计如下:
【查阅资料】:氢氧化钠溶液与空气接触可能发生的反应:
2NaOH+CO 2═Na 2CO 3+H 2O
Na 2CO 3+CO 2+H 2O═2NaHCO 3
NaOH与NaHCO 3在溶液中发生反应:
NaOH+NaHCO 3═Na 2CO 3+H 2O
【假设猜想】:1.该溶液未变质,溶质成分只有NaOH
2.该溶液已变质,…
【实验探究】:向一定质量的洁净烧杯中加入m 1g该氢氧化钠溶液,再加入溶质质量分数为20%硫酸m 2g(硫酸 足量),充分反应、冷却后称量.根据溶液总质量m判断该氢氧化钠溶液是否变质.
试结合该方案,回答下列问题:
(1)进行上述实验使用的称量仪器名称是 ,称量时,烧杯应放在该仪器的 盘.
(2)实验探究中,烧杯内溶液总质量m与氢氧化钠溶液是否变质的对应关系是:
m<(m 1+m 2)g,猜想 成立;m=(m 1+m 2)g,猜想 成立.
(3)补充完善猜想2:如果该溶液部分变质,溶质的成分为 (填化学式,下同);
如果该溶液完全变质,溶质成分可能为Na 2CO 3或NaHCO 3或 .
某化学兴趣小组的同学在实验室发现以前用的一瓶氢氧化钠溶液忘记了盖瓶塞,他们取这种氢氧化钠溶液少量于试管中,再逐滴加入稀盐酸,观察到有气泡产生.小组中有同学断定,这瓶氢氧化钠溶液已经变质.辅导老师肯定了该同学的看法,又有同学提出:所用氢氧化钠溶液是否完全变质?兴趣小组的同学在辅导老师的鼓励下又进行了如下的实验探究:
【提出问题】氢氧化钠溶液是否完全变质?
【进行猜想】(1)该氢氧化钠溶液部分变质;(2)该氢氧化钠溶液全部变质.
【查阅资料】氯化钡溶液呈中性.
【设计并进行实验】
|
实验步骤 |
实验现象 |
实验结论 |
|
(1)取少量该瓶氢氧化钠溶液于水管中,向溶液中滴加过量的BaCl2溶液,并不断振荡 |
有 产生 |
说明原溶液中一定有碳酸钠 |
|
(2)取步骤(1)试管中的少量上层清液,向其中滴加酚酞试液 |
发现溶液变红色 |
说明原溶液中一定有 . |
【结论】该小组同学所用的氢氧化钠溶液是 (填“部分”或者“全部”)变质.
【反思】氢氧化钠溶液露置于空气中容易变质,反应的化学方程式为: .
在学习《常见的碱》课题时,某化学兴趣小组在实验室发现一瓶标有澄清石灰水的试剂瓶底有一些白色固体物质.课后同学们对这瓶石灰水是否变质进行了探究.
[提出猜想]甲同学认为:石灰水完全变质;
乙同学认为:石灰水部分变质;
丙同学认为: .
[实验方案]
|
实验 |
现象 |
结论 |
|
|
甲的探究 |
从试剂瓶中取适量清液于试管中,向其中通入CO2气体 |
|
甲的猜想正确 |
|
乙的探究 |
实验一:从试剂瓶中取适量清液于试管中,向其中滴加酚酞试液 |
|
乙的猜想正确 |
|
实验二: |
|
[分析与讨论]
大家通过分析和讨论认为:如果丙同学的猜想也正确,则瓶底的白色固体物质是 (填化学式),其产生的原因是 .
一次用餐中,小丽对"固体酒精"产生好奇,于是她买回一袋,和同学一起对其进行研究.
【查阅资料】固体酒精中含有酒精、氢氧化钠等物质.
【提出问题】固体酒精中的氢氧化钠是否变质及变质的程度如何?
【提出猜想】小丽猜想:没有变质,只含有氢氧化钠.
小明猜想:全部变质,只含有碳酸钠.
你的猜想:部分变质,含有 .
氢氧化钠在空气中变质的化学方程式 .
【实验探究】小丽取少量固体酒精在水中充分溶解后过滤,取上述滤液于试管中,滴入几滴稀盐酸,无明显现象;小丽说氢氧化钠没有变质,小明认为她的结论不正确,其理由是 .
请你补全实验设计,填写表格中的①②③,证明固体酒精中氢氧化钠是否变质及变质的程度如何.
|
实验操作 |
实验现象 |
实验结论 |
|
① |
有气泡产生 |
小丽猜想不成立 |
|
② |
③ |
你的猜想成立 |
【拓展应用】除去部分变质的氢氧化钠溶液中的杂质,方法是 (用化学方程式表示).