利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。每次取1000g样品配制成溶液,向其中加入10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:
| 测定次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 样品质量(g) |
1000 |
1000 |
1000 |
1000 |
| 氢氧化钠溶液质量(g) |
320 |
640 |
820 |
900 |
| 沉淀质量(g) |
23.2 |
46.4 |
58 |
58 |
(1)求粗盐的纯度(写出解题过程)。
(2)当样品与所加氢氧化钠溶液恰好完全反应时溶液中氯化钠的质量为多少?
甲、乙、丙、X是初中化学常见的物质,分别属于单质、氧化物、酸、碱、盐中的不同类别,且各物质之间的关系如下图所示(图中“ ”表示相连的物质间可以发生反应,“ ”表示物质间存在转化关系)。
”表示物质间存在转化关系)。
已知X是植物光合作用的气体原料,丙为黑色固体。
(1)X的名称为 ;丙物质的化学式为 。
(2)若甲与X的组成中不含相同的元素,且甲能与乙发生反应,该反应的化学方程式为 。
实验室用大理石与稀盐酸反应制取CO2,反应后所得溶液体积为40mL.(假设大理石中的杂质不与盐酸反应,反应前后溶液体积不变).向该溶液中匀速逐滴加人Na2CO3溶液 并不断搅拌,测得溶液的pH随时间变化如图所示,该过程 共放出气体660mL(密度为2.0g/L)析出沉淀5.0g.
(1)根据图象可以看出.Na2CO3首先与溶液中的 反应.
(2)本实验制取CO2所用大理石中含CaCO3 g.
(3)已知制取CO2所用稀盐酸的密度为1.06g/Cm3求这种盐酸的质量分数.(计算结果保留1位小数,无计算过程不给分)
(6分)如图以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同.结合此图回答下列问题:
(1)Ca(OH)2的俗名是__________________(填一种即可);
(2)反应②为__________(填“放热”或“吸热”)反应;
(3)反应⑤的化学方程式为 ;此反应属 于___________(填基本反应类型);
(4)图中只生成盐和水的反应有 (填序号);
(5)若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是(BaCl2、CuSO4、K2CO3)中的 。
下列是初中化学常见物质间的转化关系,这些物质由碳、氢、氧元素组成的,其中,甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同,其余反应条件、部分反应物已略去,试推断:
(1)转化①的化学方程式为 ;
(2)转化①转化②均属于 (填基本反应类型);
(3)选择图中物质实现转化③,则物质C的化学式为 ;
为除去下列物质中的杂质(括号内为杂质),选用的试剂和操作方法都正确的是
| 序号 |
物 质 |
选用试剂 |
操作方法 |
| A |
CO2气体(HCl) |
NaOH溶液 |
洗气 |
| B |
FeSO4溶液(CuSO4) |
Al粉 |
加过量Al粉、过滤 |
| C |
KNO3固体(KOH) |
H2O、CuSO4溶液 |
溶解、过滤、蒸发结晶 |
| D |
NaCl固体(MgCl2) |
H2O、NaOH溶液、盐酸 |
溶解、加过量NaOH溶液、过滤、加过量盐酸、蒸发结晶 |
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 |
1 |
2 |
3 |
| 盐酸质量 |
5g |
5g |
5g |
| 氢气质量 |
0.04g |
m |
0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
海水是巨大的资源宝库,利用海水为原料获得许多化工产品的流程如下图: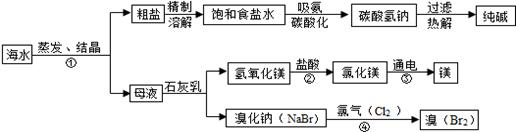
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、 、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是 。
(3)由上述流程图看出碳酸氢钠的热稳定性 (填“大于、小于或等于)纯碱的热稳定性。
(4)步骤②发生的反应属于 反应(填一种基本反应类型)。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有 (任答一点)。
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),
反应后溴元素的化合价比反应前 (填“升高”或“降低”或“不变”)。
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
| 编 号 |
第 1 次 |
第 2次 |
第 3次 |
| 所取固体样品的质量/g |
13 |
10 |
10 |
| 样品用98g水溶解后,加入CaCl2溶液的质量/g |
100 |
100 |
125 |
| 反应后生成沉淀的质量/g |
8 |
8 |
8 |
完成下列计算:
①固体样品中氯化钠的质量分数是 ;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)
推理是学习化学的一种重要方法,以下类推正确的是
| A.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成的 |
| B.在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定都显负价 |
| C.碳酸盐与稀盐酸反应生成气体,所以与稀盐酸反应生成气体的物质一定是碳酸盐 |
| D.在化学反应中,一氧化碳和氢气都能夺取氧化铜中的氧,所以一氧化碳和氢气都具有还原性 |
下列图像与对应的说法正确的是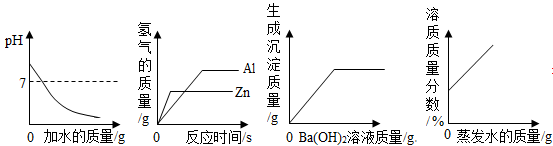
| A.向NaOH溶液中加水稀释 |
| B.等质量的Al、Zn与足量的稀硫酸反应 |
| C.向稀硫酸中加入Ba(OH)2溶液 |
| D.在恒温的条件下,适量蒸发饱和NaCl溶液的水分 |
某白色固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠中的一种或几种;某无色溶液乙是初中化学常见的一种可溶性钡盐溶液。为探究白色固体甲的成分,进行如下实验。对于固体甲的分析错误的是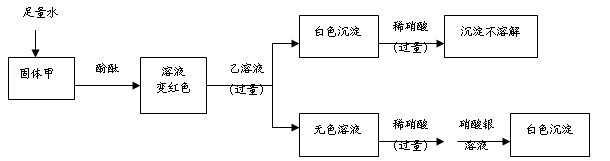
| A.一定有硫酸钠 |
| B.一定有氢氧化钠 |
| C.若乙溶液为硝酸钡溶液,一定有氯化钠 |
| D.至少含有碳酸钠、氢氧化钠中的一种 |
下列用字母表示的八种物质是初中化学常见的物质,它们是由H、C、O、S、
Ca、Fe、Cu七种元素中的一种或两种组成。
(1)A、B、C三种物质之间可以发生两个反应:A+B→C,C→A+B。其中A是最清洁的燃料,请写出C→A+B反应的化学方程式 。
(2)D的一种单质在B中燃烧生成一种无色无味气体E,将该气体通入紫色石蕊溶液中,溶液变为红色,请用化学方程式表示石蕊溶液由紫色变为红色的原因 。
(3)F与某红色氧化物在一定条件下反应生成X和E,F和E元素组成相同。该反应的化学方程式为 。
学习碱的个性时,同学们在实验室中做“检测氢氧化钙性质 ”的实验,实验方案如图所示(说明:实验中使用的药品均是溶液)。
请回答下列问题:
(1)写出盐酸加入氢氧化钙中反应的化学方程式: ;在实验过程中 ,并没有观察到该反应的明显现象 ,请你写出一种能观察到变化发生的方法: 。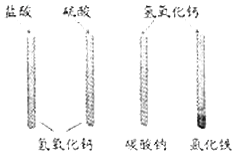
(2)实验结束后,同学们将四支试管中的物质全部倒入废液缸中,为了处理废液渣,首先对废液缸中物质的成分进行初步分析,过程如下图所示:
由上述分析可知:
①固体A中一定还有碳酸钙和 。
②无色溶液 B中使酚酞试液变红的物质是 。
已知A、B、C、D、E、F是初中化学中常见的六种物质,它们之间在一定条件下有如图所示的转化关系(图中“→”表示物质间存在转化关系,“ ”表示两种物质间能发生反应)。又知A、B、D都是由两种元素组成,且A、B所含元素各不相同;C、E均含三种元素,其中E常用来改良酸性土壤;F是一种能维持生命活动的单质(通常状态下为气体)。请按要求回答下列问题:
(1)写出F的名称 ,E的俗名 ;A的化学式 ;
(2)写出下列反应的化学方程式:
①B+D: ;
②写出一种能生成C,且反应物为两种盐的复分解反应: 。
(8分)甲、乙、丙、丁、戊分别是稀硫酸、镁、氢氧化钠溶液、氧化镁及硫酸铜溶液中的一种。下图反映了它们之间的相互关系。其中“一”表示相连的物质间可以相互反应,“→”表示甲在一定条件下可以转化为戊。已知丁溶液呈蓝色。请回答以下问题:
(1)写出下列物质(或溶质)的化学式:
甲 、戊 。
(2)图中各反应不含有四种基本反应类型中的 反应。
(3)写出下列反应的化学方程式:
乙与丙: 。
丙与丁: 。
(4)例举丙在生产、生活中的一种用途: 。