扁桃酸衍生物是重要的医药中间体,以
和
为原料合成扁桃酸衍生物F路线如下:
(1)
的分子式为
,可发生银镜反应,且具有酸性,
所含官能团名称为:_,写出
的化学反应方程式为.
(2) 中①、②、③3个
的酸性有强到弱的顺序是:。
中①、②、③3个
的酸性有强到弱的顺序是:。
(3)
是由2分子
生成的含有3个六元环的化合物,
的分子中不同化学环境的氢原子有种。
(4)
的反应类型是,1
在一定条件下与足量
溶液反应,最多消耗
的物质的量为:_
.
写出符合下列条件的 的所有同分异构体(不考虑立体异构)的结构简式:
①、属于一元酸类化合物,②、苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:
有多种合成方法,在方框中写出由乙酸合成
的路线流程图(其他原料任选)合成路线流程图示例如下:
(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
① 写出元素符号:A,C,E。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出E2C的电子式:。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
① 阴影部分元素N在元素周期表中的位置为第周期第族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④ 下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。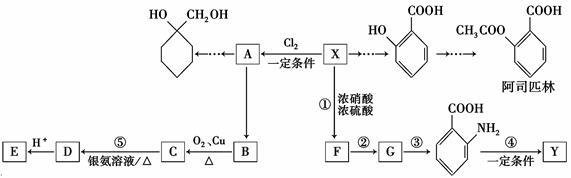
已知:
①X为芳香烃,其相对分子质量为92
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:
③ (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为______________,其侧链氢原子全部被苯环取代后,最多有 个碳原子共面;(2) 的名称为____________________,G中官能团名称为___________;
的名称为____________________,G中官能团名称为___________;
(3)反应③的反应类型是________;已知A为一氯代物,则E的结构简式是____________;(4)反应④的化学方程式为__________________________________________;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有________种:
①含有苯环;
②既不能发生水解反应,也不能发生银镜反应;
③1 mol该有机物能与2 molNaHCO3完全反应。
(6)参照上述合成路线,结合所学知识,设计一条以A为原料制备 的合成路线(无机试剂任用)。合成路线流程图示例如下:
的合成路线(无机试剂任用)。合成路线流程图示例如下: 。
。
咖啡酸是一种在医学上具有较广泛的作用的医药中间体和原料药。
咖啡酸苯乙酯是一种天然抗癌药物,由苯乙烯合成咖啡酸苯乙酯的过程之一是:
(1)化合物I的分子式为;反应③的反应类型为。
(2)若化合物II和III中的“Ph”为苯基、“P”为磷原子,则化合物II的结构简式为
;咖啡酸苯乙酯的键线式结构简式为。
(3)足量的溴水与咖啡酸发生反应的化学方程式为。
(4)下列说法错误的是;
| A.化合物I能发生银镜反应 |
| B.苯乙烯发生加聚反应生成热固型塑料 |
| C.苯乙醇能使酸性高锰酸钾褪色 |
| D.镍催化下,1mol咖啡酸最多可加成4molH2 |
E.化合物IV的同分异构体中,含 的芳香化合物共有5种
的芳香化合物共有5种
(5)环己酮( )与化合物II也能发生反应①的反应,则其生成含羧基的化合物的结构简式为。
)与化合物II也能发生反应①的反应,则其生成含羧基的化合物的结构简式为。
【化学一选修5有机化学基础】合成药物醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为: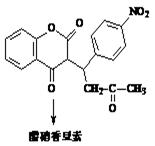
醋硝香豆素可以通过以下方法合成(部分反应条件省略)。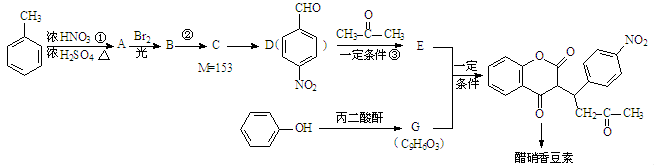
已知:①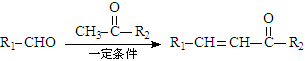 + H2O
+ H2O
②两个羧基脱去一个水即生成该酸的酸酐
③G含有两个六元环
回答以下问题:
(1)反应②的反应类型是。
(2)E中含氧官能团的名称是。
(3)反应①的化学方程式:。
(4)反应C→D的化学方程式:。
(5)关于醋硝香豆素下列说法不正确的是(填字母序号)。
a.含有三种官能团
b.可与新制的银氨溶液反应
c.可以发生加成反应、氧化反应和还原反应
d.在一定条件下与H2发生加成反应,最多消耗9mol H2
(6)写出G的结构简式。
(7)分子中只有一个环,且同时符合下列条件的同分异构体共有种。
①与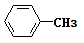 互为同系物;
互为同系物;
②相对分子质量比甲苯大28。
其中,一氯代物只有两种同分异构体的结构简式为。
兔耳草醛 是一种重要的香料。用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:
是一种重要的香料。用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:
已知:
试回答下列问题:
(1)兔耳草醛的分子式是,物质A的结构简式是;
(2)检验C中含有的碳碳双键所用试剂是(单选);
| A.酸性KMnO4溶液 | B.新制备Cu(OH)2悬溶液 | C.溴水 | D.溴的CCl4溶液 |
(3)C→D的反应类型是:,其反应的化学方程式为:
(注明反应条件);
(4)兔耳草醛中的含氧官能团易被氧化,生成化合物W,化合物W的结构简式是。
(5)有机物I有多种同分异构体,其中一类同分异构体能使FeCl3溶液显紫色,结构中不含—CH3,且苯环上只有两个互为对位的取代基,其可能的结构简式为(写出一种)。
有机物F的合成路线如图所示:
回答以下问题:
(1)E→F的反应类型是 。
(2)A的结构简式为 ,G的结构简式为 。
(3)检验E中含氧官能团的试剂是 ,现象是 。
(4)B生成C的化学方程式为 。
(5)A的同分异构体中,符合下列条件的同分异构体有 种(不包含A),写出其中一种的结构简式 。
①属于芳香族化合物 ②苯环上有四个取代基 ③苯环上的一溴取代物只有一种
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
(1)若A为气体单质,则① B→E的化学方程式 ;
② 标准状况下,若将充满干燥D气体的烧瓶倒置于水槽中,烧瓶内液面逐渐上升,(不考虑烧瓶内溶液扩散因素),则最终烧瓶内所得溶液的物质的量浓度为 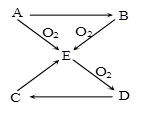
(2)若A为固体单质,且易溶于二硫化碳,则 ① D的分子式 为 ;
② C→E的化学方程式为 ;
③ 将E通入某些单质的溶液中,可发生反应生成两种强酸,试举一例写出化学方程式 。
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图: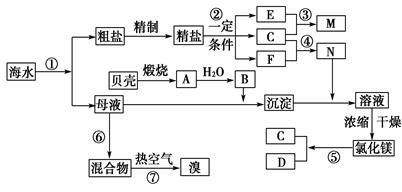
Ⅰ.(1)写出N的化学式_________________________;
(2)写出反应②的化学方程式_________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、
SO42-等杂质,精制时所用的
试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为____________。
A.②③④① B.③④②① C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是____________。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是____________。
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2 乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?______(填“甲”或“乙),理由是____________________________ ___。
Ⅰ.某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)写出A的结构简式 。
(2)A中的碳原子是否都处于同一平面? (填“是”或者“不是”)。
Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:  。它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
。它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(3)下列有关“亮菌甲素”的叙述正确的是 (填字母)。
| A.“亮菌甲素”能与H2发生加成反应 |
| B.不能使酸性KMnO4溶液褪色 |
| C.“亮菌甲素” 的分子式是C12H10O5 |
| D.“亮菌甲素”分子中含氧官能团只有2种 |
(4)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其所有属于醇类的同分异构体的结构简式 。
(5)依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇的结构简式 。
聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用。下图是利用乙酰丙酸(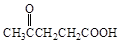 )合成聚芳酯E的路线:
)合成聚芳酯E的路线: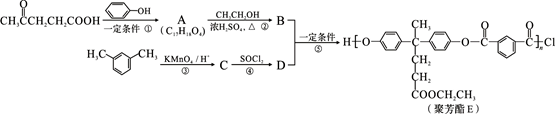
已知:①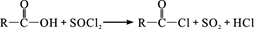
②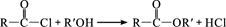 (R、R′表示烃基)
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和 (填官能团名称)。
(2)D的结构简式为 。
(3)下列关于有机物B的说法正确的是 (填字母代号)。
a.能发生取代反应
b.能与浓溴水反应
c.能发生消去反应
d.能与H2发生加成反应
(4)A→B的化学方程式为 。
(5)C的分子式为 ,符合下列条件的C的同分异构体有 种。
①能发生银镜反应
②能与NaHCO3溶液反应
③分子中有苯环,分子中无 结构
结构
在上述同分异构体中,有一种苯环上有两个取代基且核磁共振氢谱图有4种峰的物质,写出该物质与足量NaOH溶液共热反应的化学方程式 。
已知A为一种盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、
H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。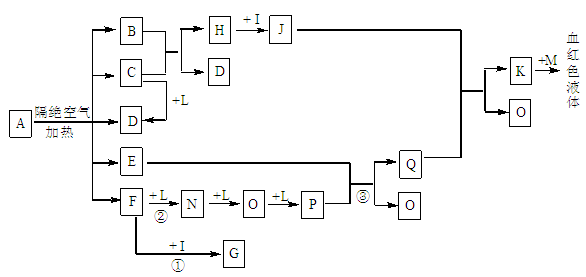
(1)写出D的电子式为_______________;
(2)写出反应②的化学方程式: ;反应③中氧化剂和还原剂的物质的量之比为_________________;
(3)将等体积、等浓度的G和F的溶液混合,溶液显碱性,则溶液中离子浓度从大到小的顺序为 ;
(4)检验J中阳离子的实验方法为 ;
(5)已知B中氧元素的质量分数为22.2﹪,且A分解产生的各物质的物质的量之比为n(B):n(C):
n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为__________________________。
[化学—选修有机化学基础]
现有分子式为CnH8O2X2的物质M,可发生如下所示转化: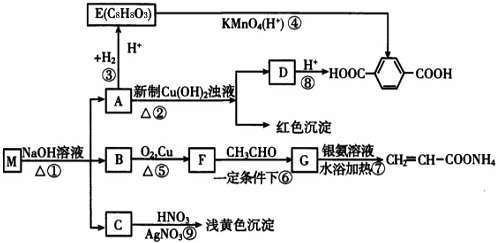
已知:①物质B在质谱分析中,在质谱图显示存在多种质荷比不相同的粒子,其中质荷比最大的为32,物质B在核磁共振氢谱分析中,有两个吸收峰,吸收峰面积之比为3:1。
②两个-OH同时连在一个C原子上,结构不稳定,会自动失水,如: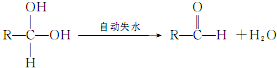
请回答下列问题:(1)n值为_______,M中官能团名称为__________。
(2)①、③的反应类型:①_______,③__________。
(3)写出M、E、G的结构简式;M:_______;G:_______。
(4)写出下列反应的化学方程式:A→D:__________。
(5)符合下列条件的E的同分异构体有_______种,写出其中核磁共振氢谱有五组峰,峰面积之比为1:1:2:2:2的同分异构体的结构简式为__________________(写一种)。
①能发生水解反应②能发生银镜反应③遇FeCl3溶液显紫色
有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华。
(c)X由A、C组成,分子中原子个数比为A:C=1:1。
(d)Y由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2。
试回答下列各小题:
(1)各元素符号:ABCDE
(2)W的电子式:。
(3)X的结构式:。
(4)Y的电子式:。
(5)Z的化学式:。
(6)写出Y与水反应的化学方程式:。
【原创】(18分)甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系。根据要求回答下列问题: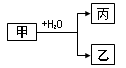
I.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性。
(1)若构成甲的阴、阳离子个数比为2:3,丙是气体。则构成甲的阴、阳离子半径大小关系为 (用具体的微粒表示)。
(2)若乙是O2,则甲的一种重要用途是 ;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是 。
Ⅱ.一种灰白色固体粉末X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:l。在一定条件下X可发生如下图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为混合气体,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。请回答下列问题:
(1)X的化学式为______________;R的电子式为_________________。
(2)写出气体P的组成 。
(3)写出D→G的离子反应方程式 。
(4)M与钛构成的合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、M3+溶液中加入M至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+==2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O ="=" TiO2+(无色)+Fe2++2H+
③ 。
请写出③可能的反应方程式 。
(5)人们对X的结构研究后发现其金属元素有0价、+2价两种化合价,写出X与稀硫酸反应的化学方程式 。
(6)聚合硫酸M是一种常见的净水剂,化学式为:[M2(OH)n (SO4)3- ]m (n>2,m≤10),其制备可由硫酸M经水解后再聚合得到,其中聚合反应的原理为m[M2(OH)n(SO4)3-
]m (n>2,m≤10),其制备可由硫酸M经水解后再聚合得到,其中聚合反应的原理为m[M2(OH)n(SO4)3- ]
]  [M2(OH)n(SO4)3-
[M2(OH)n(SO4)3- ]m,则写出硫酸M水解的化学方程式为 。
]m,则写出硫酸M水解的化学方程式为 。
【命题立意】本题综合考查元素及其化合物的知识,融入信息型化学方程式的书写,旨在考查考生知识迁移能力以及应用化学原理解决实际问题的能力。