[化学 ― 选修 5 :有机化学基础]呋喃酚是生产呋喃丹、好安威等农药的主要中间体,是高附加值的精细化工产品。一种以邻氯苯酚(A)为主要原料合成呋喃酚(F)的流程如下:
回答下列问题:
(1)A 物质核磁共振氢谱共有 个峰,④的反应类型是 ,C和D中含有的相同官能团的名称是 。
(2)下列试剂中,能和D反应的有 (填标号)。
A.溴水 B.酸性K2Cr2O7溶液 C.FeC12溶液 D.纯碱溶液
(3)写出反应①的化学方程式是 (有机物用结构简式表示,下同)。
(4)有机物B可由异丁烷经三步反应合成:
条件a为 ,Y生成B的化学方程式为 ;
(5)呋喃酚的同分异构体很多,写出符合下列条件的所有同分异构体的结构简式
①苯环上的一氯代物只有一种
②能发生银镜反应的芳香酯
苯酚是一种重要的化工原料,以下是以苯酚为原料,生产阿司匹林、香料和高分子化合物的合成线路图。
(3)R—OH+HBr R—Br+H2O
R—Br+H2O
(1)写出反应类型:反应④属于_____________反应,反应③属于________________反应。
(2)写出下列有机物的结构简式:E___________、G_____________、F____________。
(3)可以检验阿司匹林样品中含有水杨酸的试剂是__________(填写字母)。
| A.碳酸氢钠溶液 | B.氯化铁溶液 |
| C.红色石蕊试液 | D.新制氢氧化铜悬浊液 |
(4)与阿司匹林互为同分异构体的物质有多种,请按以下要求写出阿司匹林的一种同分异构体:①苯环上有两个对位的取代基;②能发生银镜反应;③含有酯基和羧基的有机物________________________。
有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C、E、G是中学化学中的常见单质,A为黑色粉末,G为黄绿色气体,E在G 中燃烧时发出苍白色火焰,F的焰色反应显黄色,B是常见的无色液体,K为红褐色沉淀。

请回答下列问题:
(1)G的化学式为 ,F的化学式为 。
(2)D、B、H混和生成J和I的离子方程式: 。
(3)常温下G与F的溶液反应的离子方程式:
(4)J转变为I的化学方程式:
(12分) 格氏试剂(RMgX)是有机反应中的一种重要试剂,它的制法为: (R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为:
(R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为: 
(R,R′可以是相同的烃基,也可能是不同的烃基)现用乙烯和适当的无机物合成乙酸异
丁酯 的过程如下(反应条件没有列出):
的过程如下(反应条件没有列出):
试回答:(1)上述过程中,属于加成反应的是_______(填反应序号),并写出下列指定
物质的结构简式C__________、E_________、F_________。
(2)反应②的化学方程式___________________________________。
(3)反应⑦的化学方程式___________________________________。
两种有机物A、B分子式均为C11H12O5,A或B在稀H2SO4中加热均能生成C和D。
已知:
①A、B、C、D能与NaHCO3反应;
②只有A、C能与FeCl3溶液发生显色反应,且核磁共振氢谱显示苯环上有两种不同化环境的氢原子;
③H能使溴水褪色且不含有甲基;
④F能发生银镜反应。
D能发生如下变化:
(1)D→H的反应类型______________________________,D中官能团名称________________________。
(2)写出C的结构简式____________________________________。
(3)D→G的化学方程式_____________________________________。
(4)B在NaOH溶液中受热的化学方程式 ____________________。
(5)C的同分异构体有多种,写出同时满足下列三个条件的同分异构体的结构简式:(任写一种)________________________。
① 苯环上一卤代物只有两种;
② 能与FeCl3溶液发生显色反应;
③ 能发生银镜反应。
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体,而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、E的化学式:A_______________;B_______________;E_______________
(2)写出F和H反应的化学方程式 。
(3)按要求写方程式:
① 加热固体D发生反应的化学反应方程式 。
② C与足量盐酸反应的离子方程式 。
③ A溶液与金属铝反应的离子方程式 。
华北地区雾霾时有发生,这与汽车尾气、工业生产排放的大量有害气体有关。下列反应中,B、C是空气质量监测的物质,其中C是红棕色气体,D是强酸(部分反应条件和产物已略去)。
A →B →C → D
(1)若A是气体单质,则A生成B的化学方程式为___________ 。
(2)若A为气态氢化物且水溶液呈碱性,则A的化学式为___________,写出A在生产生活中的一种用途_____________。
(3)D的浓溶液与铜反应的化学方程式为____________,在此反应中体现了硝酸_______性和_______性。
短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).
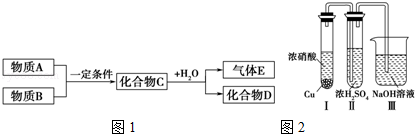
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式 ,并任写一种C的主要用途 .
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): .
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系: .
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 .
②已知常温下物质A与物质B反应生成1mol气体C的△H=﹣57kJ•mol﹣1,1mol气体C与H2O反应生成化合物D和气体E的△H=﹣46kJ•mol﹣1,写出物质A与物质B及水反应生成化合物D的热化学方程式为 .
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是 .
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 .
某溶液中可能存在下列离子:NH4+、Fe2+、Cl-、SO42-、CO32-中的一种或几种,某同学为了检验它们的存在,进行了如下实验:
①取少量该溶液加入过量的Ba(NO3)2溶液,产生白色沉淀,过滤,得沉淀和滤液;
②向①的沉淀中加入足量的稀硝酸,发现沉淀不溶解;
③向①的滤液中加入硝酸银溶液,未见白色沉淀;
④再取少量原溶液加入2滴KSCN溶液,无明显现象,继续加入氯水,溶液立即变为血红色。
(1)则原溶液中一定存在的离子是______________;
(2)一定不存在的离子是______________;
(3)可能存在的离子是_________,为进一步确定该离子是否存在,该同学还应补做的实验是___________。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生白烟,A是强碱,D的焰色反应呈紫色(部分反应物和生成物及溶剂水已略去)。
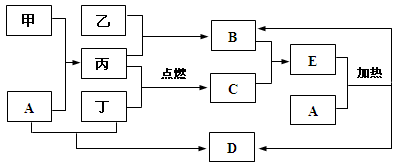
请回答下列问题:
(1)D的化学式为 。
(2)C的电子式为 。
(3)写出A溶液和甲反应的离子方程式: 。
(4)写出工业上制备B的化学方程式: 。
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知:
请回答下列问题:
(1) 试剂Y的结构简式为________________。
(2) A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式____________。
(3) B的分子式为___________;写出同时满足下列条件的B的链状同分异构体的结构简式:________________。
① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应
用CO2 和环氧化物共聚合成全降解二氧化碳基塑料,既可有效解决CO2过量排放引起的温室效应、又可除去白色污染。已知该反应为:

(-R、-R'代表烃基或氢原子)
(1)该反应为 反应。
(2) 的单体是 。
的单体是 。
通过下列途径既可以得到全降解二氧化碳基塑料还可得到用途广泛的高分子化合物PA66。
已知:

(3)A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比为1:2,则
①A的结构简式是____________,名称是 。
②B是顺式结构, B→C的化学方程式是 。
③由E制备二氧化碳基塑料的化学方程式是 。
(4)D的一种同分异构体在相同条件下也能制得E,其结构简式是 。
(5)已知1 molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),则
①1 mol E与2 mol HCl反应的化学方程式是 ___________________。
② G和H在一定条件下生成PA66的化学方程式是 。
已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为 。
增塑剂(DEHP)存在如下图所示的转化关系,其中A是对二甲苯(英文名称pxylene,缩写为PX)的一种同分异构体。

(1)B的苯环上存在2种不同化学环境的氢原子,则B的结构简式:_________________。
(2)D分子所含官能团:____________(填名称)。
(3)C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式:__________________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物; b.遇FeCl3溶液显示特征颜色; c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式:___________________________________。
【化学一有机化学基础】(13分)
已知: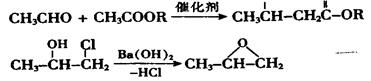
杨梅酯是制作冰制食品、糖果等的香料,可由如下路线合成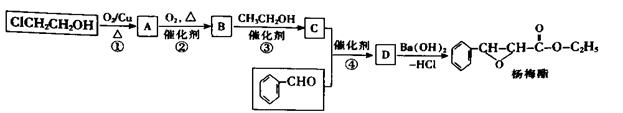
(1)杨梅酯在一定条件下水解生成。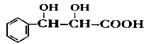 下列有关该物质的叙述中,正确的是________。
下列有关该物质的叙述中,正确的是________。
| A.能与溴的四氯花碳溶液发生加成反应 |
| B.无法使酸性高锰酸钾溶液褪色 |
| C.可能发生消去反应 |
| D.可能发生缩聚反应 |
(2)B中的官能团名称为_____________。
(3)①的化学方程式为____________________________,反应类型为____________________.
(4)D 的结构简式为__________________________________。
(5)写出符合下列条件的杨梅酯的一种同分异构体的结构简式________________________。
①苯环上有1,3,5三个取代基;
②苯环上一氯取代物有两种;
③lmol 该物质与新制Cu(OH)2, 悬浊液反应理论上可生成2lmol Cu2O