非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
(1)O2-的离子结构示意图为 ,CS2的晶体类型为 晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是 ;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用 。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于 。
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式 。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,常用于水的消毒杀菌和织物的漂白。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:

(1)反应I中的Na2SO3长期存放通常含有Na2SO4杂质,可用滴定法测定Na2SO3的纯度,向Na2SO3溶液中滴加酸性KMnO4溶液,判断滴定终点的现象为_______________。
(2)Ⅱ中反应的离子方程式是_____________________________________________。
(3)A的化学式是________________,装置Ⅲ中b在 极区产生。
[化学——选修2]化学与技术:(15分)硫酸是重要的工业原料.工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,其生产流程图如下:
(1)操作I的内容是 ,此操作目的是 .物质B是 .a= 。
(2)工业上既可用硫黄也可用硫铁矿(FeS2)造气,若使用硫铁矿造气.另一产物是一种常见的红棕色固体.写出用硫铁矿造气时反应的化学方程式 。
(3)催化反应室中的反应是一个气体体积缩小的反应.增大压强有利于反应向右进行.但实际生产却是在常压下进行的.原因是 。
(4)工业生产中常用氨一硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的.用两个化学方程式表示其反应原理 。
(5)若用等质量的硫黄、FeS2生产硫酸.假设原料的总利用率均为90%.则二者得到硫酸的质量比为 。
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为Cu0/Zn0/Al2 O2):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是 。
| A.CO和H2的物质的量浓度比是1:2 |
| B.CO的消耗速率等于CH3OCH3的生成速率的2倍 |
| C.容器中混合气体的体积保持不变 |
| D.容器中混合气体的平均摩尔质量保持不变 |
E.容器中棍合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(3)复合催化剂的制备方法之一是Na2 C03共沉淀法:制备1 mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液。然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1 mol/L的Na2C03水溶液,70℃下搅拌混合。沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时。请写出上述过程中硝酸铝与Na2C03水溶液反应的离子方程式:
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下: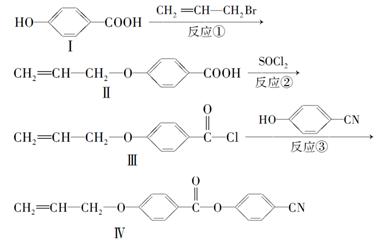
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2=CH—CH2Br与NaOH水溶液反应的化学方程式为(注明条件)______________。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应显紫色 |
| C.一定条件下能发生加聚反应 | D.能使溴的四氯化碳溶液褪色 |
(5)反应③的反应类型是________。在一定条件下,化合物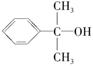 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
已知:N2O4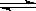 2NO2,△H>0,
2NO2,△H>0,
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂 D、升高温度
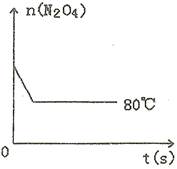
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
[化学—选修3:物质结构与性质]
(1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 ;
③下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为140-145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则 Si60分子中的数目为 。
一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行 Fe2+ Fe3+的转化时,②中的Fe3+作 剂(填“氧化剂”或“还原剂”);
Fe3+的转化时,②中的Fe3+作 剂(填“氧化剂”或“还原剂”);
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作 剂;
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的化学方程式为 ;
(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆。
其中富含维生素C的食物为 ,食醋中常用的防腐剂为 ,小华同学为了证明该食堂所提供的牛奶中没有添加米汤,他应该做的实验以及观察到的现象为 ;
(5)小芳同学在这次晚饭中食用了2 g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg)。
(设每千克加碘食盐中含KIO3 40 mg,计算结果保留两位小数)
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:
CO(g) +Cl2(g)  COCl2(g) ΔH =" a" kJ/mol
COCl2(g) ΔH =" a" kJ/mol
反应过程中测定的部分数据如下表:
| t/min |
n (CO)/mol |
n (Cl2)/mol |
| 0 |
1.20 |
0.60 |
| 1 |
0.90 |
|
| 2 |
0.80 |
|
| 4 |
|
0.20 |
(1)反应0~2min末的平均速率v(COCl2)=______________mol/(L∙min)。
(2)在2min~4min间,v(Cl2)正______________v(Cl2)逆(填“>”、“=”或“<”),该温度下K =_________。
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图

(4)已知X、L可分别代表温度或压强,下图表示L一定时,CO的转化率随X的变化关系。

X代表的物理量是___________;a_______0 (填“>”,“=”,“<”),依据是___________。
玻璃容器被下列物质沾污后,需要洗涤。如洗涤方法属于物理方法的,请写出所需试剂;洗涤原理属于化学反应的,写出有关反应的离子方程式;若无法用试剂使容器复原者,请说明原因。
(1)盛石灰水后的沾污:
(2)碘的沾污:
(3)硫的沾污:
(4)长期盛强碱溶液的试剂瓶变“毛”了。
Ⅰ已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H=_1275.6kJ•mol-1
②H2O(l)═H2O(g) △H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式: 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断⑴中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH) = 3v逆(H2) ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
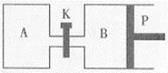
Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题:
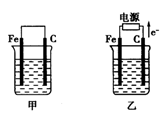
(1)若两池中均盛放CuSO4溶液,甲池中石墨棒上的电极反应式为____________________.
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
“绿色奥运”是北京2008奥运会的三大主题之一,使用清洁能源,防治交通污染,改善空气质量,加速建设污水处理和回收工程,防止固体废弃物污染,植树造林,促进生态良性循环等,是北京实现“绿色奥运”主要工作。北京申奥时向国际奥委会承诺:位于北京城西的首都钢铁公司在2008年前迁出。
(1)首钢为什么会对北京市区环境造成污染?
(2)其主要的大气污染物各是怎样形成的(写出必要的化学方程式)?
(3)请用化学方程式表示其中任意一种污染物对北京造成的危害。
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
(1)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸。
已知:①N2(g)+O2(g)=2NO(g) △H="+180.5" kJ/mol
②N2(g)+3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
③2H2(g)+O2(g) = 2H2O(g) △H=-483.6 kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)  2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):

①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1 mol N2,n(H2)=3mol,经过5 min反应达到平衡时H2的转化率为60%,则v(NH3)= 。保持容器体积不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___110.88 kJ(填“>”、“<”或“=”)。
工业上利用氨氧化获得的高浓度气体(含
、
)制备
、
,工艺流程如下:

已知:+
+
=2
+
(1)中和液所含溶质除及少量
外,还有(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是。蒸发Ⅰ产生的蒸气中含有少量的等有毒物质,不能直接排放,将其冷凝后用于流程中的(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀的目的是。母液Ⅱ需回收利用,下列处理方法合理的是。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作
(4)若将、
两种产品的物质的量之比设为2:1,则生产1.38吨
时,
的理论用量为吨(假定
恰好完全反应)。