写出下列化学反应方程式:
(1)用电石制备乙炔:。
(2)乙醛与银氨溶液发生银镜反应:。
(3)将灼热的铜丝浸入少量乙醇液体中:。
(4)甲苯与浓硝酸和浓硫酸混合液共热生成三硝基甲苯:。
(5)1,3-二溴-2,3-二甲基丁烷与NaOH的醇溶液共热:。
氢气是一种清洁能。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为,随着温度升高该反应的化学平衡常数的变化趋势是。
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是_______(填序号)。
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b. 单位时间内断开amol H-H键的同时断开2a mol O-H键
c. 反应容器中放出的热量不再变化
d. 混合气体的密度不再发生变化
e. 混合气体的压强不再发生变化
(4)某温度下,第II步反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2O)/ mol/L |
0.010 |
0.020 |
0.020 |
| c(CO)/ mol/L |
0.010 |
0.010 |
0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D. 平衡时,乙中H2O的转化率大于25%
人们每天都要摄入大量的淀粉类物质,以维持机体的营养均衡。这是因为淀粉在淀粉酶作用下或在酸性环境下可以水解成葡萄糖:
(1)已知葡萄糖化学式是C6H12O6,试推导葡萄糖分子的结构简式,已知多元醇与新制Cu(OH)2悬浊液混合可形成绛蓝色溶液。
(2)实验证明,人在长期饥饿或肝功能减退的情况下,会出现头晕、心慌、出冷汗等症状。而当一个人多食少动使得摄入的糖类过多时,又会导致肥胖。试由此推导葡萄糖在人体内的变化。
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是(写化学式)
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)
、。
(3)烧碱、纯碱均可吸收CO2,当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况。按吸收CO2由少到多的顺序,四种固体组成的化学式分别是:, ,,。
某链烃3.6g和Cl2发生取代反应,控制反应条件使其仅生成一氯代物,将反应生成的气体(一氯代物为液体)用NaOH溶液吸收恰好和0.1mol·L-1 NaOH溶液500mL完全反应,试解答下列问题:
(1)求该烃的相对分子质量;
(2)若该烃既不能使酸性KMnO4溶液褪色,又不能使溴水褪色,试求该烃的分子式。
(3)若该烃的一氯代物只有一种,试确定该烃的结构简式 (要求写出计算过程)
A、B、C、D、E 五种短周期主族元素分占三个周期。A、B、C为同一周期依次相邻的3种元素;A和C的原子核外P能级中都有两个未成对电子,其中A的P能级有一个空轨道;E原子的电子层数等于最外层电子数,D的原子序数是E的1/13倍。请回答相关问题:
(1)A元素在周期表中的位置;写出B的电子排布式。
(2)比较C和E简单离子半径大小:(用离子符号表示);比较B和C第一电离能大小:(用元素符号表示)。
(3)元素E的一种常见的可溶性盐溶液呈酸性,其原因是(用离子方程式表示):。
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体。
①丙的电子式为。
②若化合物甲的电子数与C元素的单质C2相同,则甲的结构式为;
③乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:。
Ⅰ、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)写出反应的化学方程式 。
(2)根据上述反应可推知______________。
a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
Ⅱ、2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。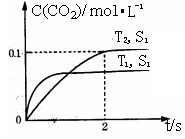
据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是 (填代号) 。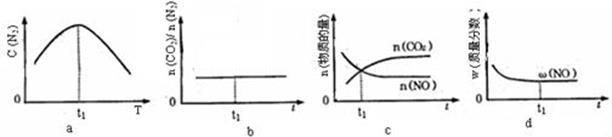
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)  N2O4(g) ΔH2=-56.9 kJ/mol
N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。
燃料电池具有高的发电效率,因而受到重视。
(1)可用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO2的混合气 为正极助燃气,制得在 650℃下工作的燃料电池,完成有关的电池反应式:负极反应2CO+2CO32--4e-=4CO2,正极反应式_
(2)某甲烷一氧气燃料电池的结构如图所示,该电池的两个电极均由多 孔碳制成,以 KOH 溶液为电解质溶液,气体由多孔碳隙逸出并在电极表 面放电,反应后溶液中 K2CO3增 多。写出该电 池的负极反应式
某含C、H、O三种元素的有机物4.6 g完全燃烧,若将生成的气体全部通过浓硫酸,则浓硫酸质量增加5.4 g;若将生成的气体全部通过足量的过氧化钠,过氧化钠的质量增加6.2 g(假定气体全部吸收)。
(1)试通过计算推断该有机物的分子式。
(2)该有机物有多种同分异构体,其中一种能和Na反应生成H2,请试写出该有机物的结构简式:________________________。
某工厂采用如图工艺处理镍钴矿硫酸浸取液(含 和 )。实现镍、钴、镁元素的回收。
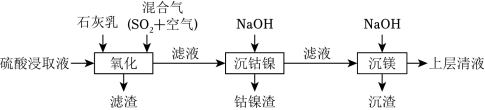
已知:
|
物质 |
Fe(OH)3 |
Co(OH)2 |
Ni(OH)2 |
Mg(OH)2 |
|
Ksp |
10﹣37.4 |
10﹣14.7 |
10﹣14.7 |
10﹣10.8 |
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为 __________(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ), 中过氧键的数目为__________。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为__________( 的电离第一步完全,第二步微弱);滤渣的成分为 、__________(填化学式)。
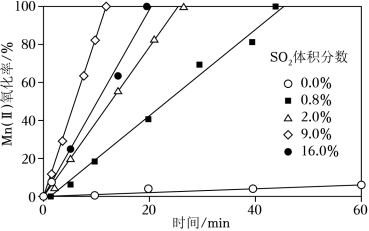
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如图。 体积分数为__________时, (Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是__________。
(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为__________。
(6)“沉镁”中为使 沉淀完全( ),需控制 不低于__________(精确至 )。
甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)═2O3(g)ㅤK1ㅤΔH1=285kJ•mol﹣1
②2CH4(g)+O2(g)═2CH3OH(l)ㅤK2ㅤΔH2=﹣329kJ•mol﹣1
反应③CH4(g)+O3(g)═CH3OH(l)+O2(g)的ΔH3= kJ•mol﹣1,平衡常数K3= (用K1、K2表示)。
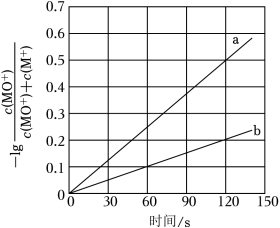
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应MO++CH4═M++CH3OH,结果如图所示。图中300K的曲线是 (填“a”或“b”)。300K、60s时MO+的转化率为 (列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如图所示(两者历程相似,图中以CH4示例)。
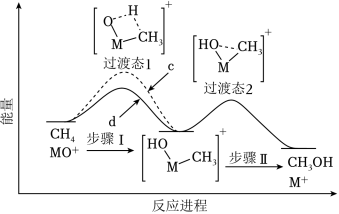
(i)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ii)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线 (填“c”或“d”)。
(iii)MO+与CH2D2反应,氘代甲醇的产量CH2DOD CHD2OH(填“>”“=”或“<”)。若MO+与CHD3反应,生成的氘代甲醇有 种。
选择适宜的材料和试剂设计一个原电池,以便完成下列反应: 2FeCl3+Cu 2FeCl2+CuCl2。画出原电池的示意图并写出电极反应。
2FeCl2+CuCl2。画出原电池的示意图并写出电极反应。
有一包白色固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):
(1)步骤“①”所用分离方法叫做 ,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做 。
(2)写出实验过程中发生化学反应的离子方程式 。
(3)固体粉末中一定不存在的物质是(填化学式,下同) ;一定存在的物质是 。
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 |
化学式 |
| Ⅰ |
|
| Ⅱ |
|
| Ⅲ |
(5)设计一个实验,进一步确定混合物的组成,简述实验操作、现象和结论。
痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,硝酸银显现法就是其中的一种:人的手上有汗迹,用手拿过白纸后,手指纹线就留在纸上.如果将硝酸银溶液小心地涂到纸上,硝酸银溶液就跟汗迹中的氯化钠作用,生成氯化银,其反应的化学方程式是.反应的类型是反应,氯化银在光照条件下分解生成银粒和另一种单质,其反应的化学方程式是.反应的类型是反应,银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由灰褐色逐渐变成黑色,从而显现出黑色的指纹线.
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235.8" kJ/mol;
己知:2 Ag2O(s)===4Ag(s)+O2(g);△H = +62.2kJ/mol;
则反应 2O3(g)= 3O2(g)的△H = kJ/mol;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产
生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为。 (2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g)某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g)某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下: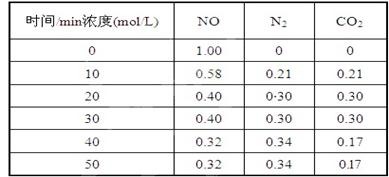
①在10 min~20 min的时间段内,以CO2表示的反应速率为;
②写出该反应的平衡常数的表达式K=;
③下列各项能作为判断该反应达到平衡状态的是(填序号字母);
| A.容器内压强保持不变 | B.2v正(NO)=v逆(N2) |
| C.容器内CO2的体积分数不变 | D.混合气体的密度保持不变 |
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。