Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下: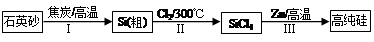
(1)焦炭在过程Ⅰ中做剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l)△H1<0
Si(S)+2ZnCl2(l)△H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g)△H2<0
Si(S)+2ZnCl2(g)△H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g)△H3<0
Si(S)+2ZnCl2(g)△H3<0
i. 反应②的平衡常数表达式为。
ii. 对于上述三个反应,下列说明合理的是。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为。
现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为,1molCS2中含有的π键为个。
(3)Y的中心原子的杂化轨道类型为,分子的立体构型为。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为,该氮化钛的化学式为,氮原子的配位数为。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为g.cm3(NA为阿佛加德罗常数值,只列式计算)。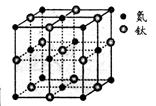
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是。
(2)该配位化合物的化学式为。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为;EDC4常作电镀液,其中DC 的空间构型是,其中D原子的杂化轨道类型是。
的空间构型是,其中D原子的杂化轨道类型是。
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: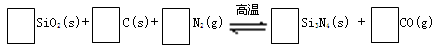
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是,其还原产物是。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
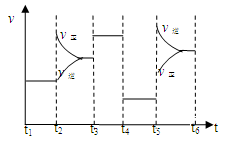
32.该反应的平衡常数表达式为K=。升高温度,其平衡常数(选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为,t5时引起v逆大变化、v正小变化的原因是。
【化学——选修2:化学与技术】
下列问题涉及煤在化工生产中的应用:
(1)煤的转化技术包括煤的气化技术和液化技术。
煤的液化技术又分为和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: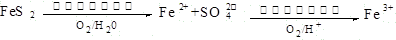
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为;第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、、等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:____________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:__________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是___________________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。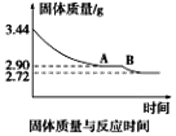
目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题: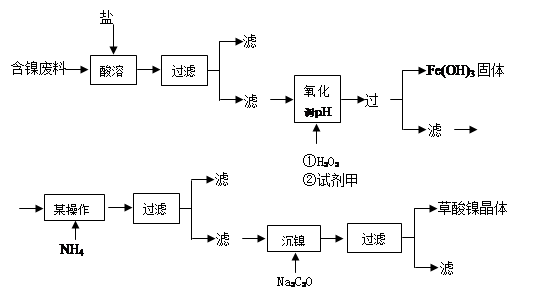
(1)加6%的H2O2时,温度不能太高,其目的是。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH=。
(3)流程中加入NH4F的目的是。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6 LaNi5+6Ni(OH)2。该电池放电时,负极反应是。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是。
近些年来,世界各地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)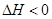 ,该反应在(填“较高温度”或“较低温度”)下能自发进行。
,该反应在(填“较高温度”或“较低温度”)下能自发进行。
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s)
第2步:NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l)
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号)。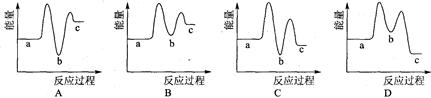
(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。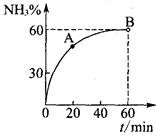
①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 物质 物质n/mol T/℃ |
活性炭 |
NO |
E |
F |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①请结合上表数据,写出NO与活性炭反应的化学方程式。
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1=,根据题给信息判断,T1和T2的关系是。
A. T1>T2 B. T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。
(1)下列四种烃分别在氧气中完全燃烧:(填字母序号)
①若烃的物质的量相等,则消耗氧气最多的是;
②若烃的质量相等,则消耗氧气最多的是;
③若反应前后(150℃)气体的物质的量不发生变化,则该烃可能是。
A.C2H6 B.C2H4 C.C4H10 D.C5H10
(2)下列各组化合物中,不论二者以什么比例混合,完全燃烧时:
①若总质量不变,耗O2量不变的是;生成水的质量不变的是。
②若总的物质的量不变,则耗O2量不变的是;生成CO2的质量不变的是。
A. C2H4、C3H6 B. HCHO、CH3COOH
C. CH4、CH3COOH D. CH2==CH2、CH3CH2OH
I.已知:C(s)+H2O(g) CO(g)+H2(g)ΔH
CO(g)+H2(g)ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100 kPa |
4.56 |
5.14 |
5.87 |
6.30 |
7.24 |
8.16 |
8.18 |
8.20 |
8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析: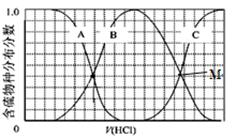
①B曲线代表分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)=。
②M点,溶液中主要涉及的离子方程式。
我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程: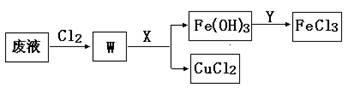
①试剂Y的名称;物质X最好是(填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol· ,则加入Cl2气和物质X使溶液的pH在范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20、lg5=0.7)
,则加入Cl2气和物质X使溶液的pH在范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20、lg5=0.7)
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)。
W (s) + 3H2O (g)。
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________。
(2) 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为___________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应(填“吸热”或“放热”)。
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g) W (s) + 2H2O (g) ΔH =" +66.0" kJ·mol-1
W (s) + 2H2O (g) ΔH =" +66.0" kJ·mol-1
WO2 (g) + 2H2 (g) W (s) + 2H2O (g) ΔH =" -137.9" kJ·mol-1
W (s) + 2H2O (g) ΔH =" -137.9" kJ·mol-1
则WO2 (s) WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 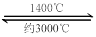 WI4 (g)。下列说法正确的有________________(填序号)。
WI4 (g)。下列说法正确的有________________(填序号)。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数Kw=。
(2)该温度下,将100mL 0.1mol/L的稀硫酸与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH=,此时该溶液中由水电离的c(OH-)=mol/L。
(3)该温度下,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前该强酸的pH1与强碱的pH2应满足的关系是。
(4)该温度下,pH=3的硫酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7);pH=3的醋酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7)。
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.lmol/L的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是(填序号)
a.装HCl溶液的试管中放出H2的速率快;
b.装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述。
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
①5 min内该反应的平均速率υ (NO) = ;在T ℃时,该反应的平衡常数K = 。
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g)ΔH =" +180.5" kJ·mol-1
2H2(g) + O2(g) = 2H2O(l)ΔH =" -571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的ΔH0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在下图中画出c(NO) 在T1、 S2条件下达到平衡过程中的变化曲线。
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。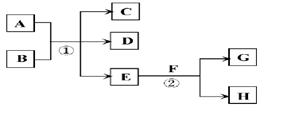
回答下列问题:
(1)写出H的电子式:
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是(用化学式填空),在检验D气体前,需除去C气体,所用试剂是,反应的离子方程式是。
②已知:A(s)+O2(g) =AO2(g)△H=-393.5kJ·mol-1
2A(s)+O2(g) =2AO(g)△H=-221.0kJ·mol-1
则AO的燃烧热的热化学方程式___________________.
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是。