大气压强对许多物理实验和化学实验有着重要影响。制取氨气并完成喷泉实验。写出实验室制取氨气的化学方程式 。

收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
用左图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
如果只提供如右图的装置,请说明引发喷泉的方法。
根据下图回答问题:
上述装置中,在反应前用手掌贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
写出浓硫酸和木炭粉反应的化学方程式: __________。
如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:A中加入的试剂是 ,作用是 ;B中加入的试剂是 ,作用是 ;C中加入的试剂是 ,作用是除尽 气体;D中加入的试剂是 ,作用是 ;E中加入的试剂是 ,作用是 。
实验时,C中应观察到的现象是 。
(15分)某同学在学习了氨的性质以后,运用类比的思想思考:(1)其他气体在一定情况下能否像氨气一样也形成喷泉?(2)氨气具有还原性,能否像H2那样还原CuO呢?于是他设计实验制取氨气并探究上述问题。请你参与他的活动并完成下列研究:
(Ⅰ)制取氨气及喷泉现象的探究
1.写出实验制取氨气的化学方程式 ;
2.收集氨气的方法是 。
3.喷泉是一种常见的自然现象。
(1)图1为化学教材中的喷泉实验装置。该生积极思考,只要满足烧瓶内压强与玻璃管水柱压强的和小于烧瓶外的压强就可以产生喷泉。于是他设计了图2和图3所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是__________。
A.Cu和稀盐酸 B.NaHCO3与NaOH溶液 C.MnO2与稀盐酸 D.Na2CO3与稀盐酸
②在图3锥形瓶中加入易挥发物质(如酒精),水槽中加入冷水后,再加入下列的物质足量,结果也产生了喷泉。水槽中后加入的物质可以是___________。
A.浓硫酸 B.食盐 C.生石灰 D.蔗糖

(2)城市中常见的人造喷泉及火山爆发的原理与上述___________(从“图1”或“图2”中选择)装置的原理相似。
(Ⅱ)该小组中某同学设计了下列所示的实验
装置(夹持及尾气处理装置未画出),探究氨气
的还原性:
|
|
|
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。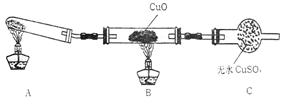
(8分)有一包白色固体,可能是、K2CO3、K2SO4、CuSO4和中的一种或几种。将此白色固体溶解于水时,有生成,过滤后,滤液为无色。
①将部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成。
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
通过上述实验现象分析:该白色固体中一定含有的物质为 ,不可能含有的物质为 ,不能确定的物质是 ,为了确定该物质是否存在,可以通过
实验确定。
下图为实验室制乙烯(A)、硝基苯(B)和石油分馏(C)的装置:
(1)在上述实验中,写出制取乙烯、硝基苯的化学方程式:
,
。
(2)在 (填字母)实验中需加碎瓷片,其目的是 。
(3)在石油分馏试验中,冷凝水的流向应是 进 出(填字母)
(4)实验室制乙烯时,有刺激性气味的气体产生,为消除其对乙烯性质实验的干扰,可将气体通过 溶液除去。若反应没有及时升温至170℃,可能带来的主要副产物是 (填名称)。
摄影胶卷上涂的感光材料主要是AgBr。在照相时按动快门的一瞬间,进入相机的光使AgBr发生了分解反应 。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
(1)曝光时所产生的微量Ag在显影过程中________。
A.是氧化剂 B.是还原剂
C.起催化剂的作用 D.不起什么作用
(2)显影液中如果只溶有对苯二酚,显影速度则非常缓慢。为提高显影速度,可加入_________。
A.Na2SO4 B.Na2SO3 C.Na2CO3 D.Na2S2O3
(3)溶于显影液中的氧气能与对苯二酚反应,最终生成棕褐色的污斑,影响底片的质量。
为避免形成污斑,可向显影液中加入__________。
A.Na2SO4 B.Na2SO3 C.Na2CO3 D.Na2S2O3
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是:CH3COOH>H2CO3>C6H5OH。
(1)利用上图所示的仪器可以组装实验装置,则仪器连接顺序为:________接________,________接________,________接________。
(2)有关反应的方程式为:________________________________________________________。
根据如图所示实验装置图,完成以下问题:
(1)这套装置可实现______________________等实验目的。
(2)仪器连接安装好进行实验前如何检查装置的气密性?答:____________________________
________________________________________________________________________________
_______________________________________________________________________________。
(3)实验时,点燃B处的酒精灯,先___________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是_____________________,发生的主要反应的化学方程式为_____________________。当反应进行一段时间后,移去酒精灯,继续不断的缓缓鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个________反应。
(4)装置C的作用是_______________,能在此处观察到的现象是________________________。
(5)D装置产生的现象是__________,发生反应的化学方程式是_________________________。
(6)E装置的试管中所得溶液的成分可能有_____________________ (写化学式)。
某化学小组采用类似制乙酸乙酯的装置(如图Ⅰ)以环己醇制备环己烯。

已知:
| |
密度(g·cm-3) |
熔点(℃)沸 |
点(℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |

图Ⅰ
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______________。
②试管C置于冰水浴中的目的是_________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。中和饱和食盐水,振荡、静置、分层,环己烯在_______________层(填“上”或“下”),分液后用_______________(填入编号)洗涤。
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液

图Ⅱ
②再将环己烯按图Ⅱ装置蒸馏,冷却水从____________口进入。蒸馏时要加入生石灰,目的是____________。
③收集产品时,控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________________________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用高锰酸钾酸性溶液 b.用金属钠 c.测定沸点
乙醇的沸点是78 ℃,能与水以任意比例混溶。乙醚(CH3CH2OCH2CH3)的沸点为34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理如下:
2CH3CH2OH CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
图6-3
(1)图6-3中甲和乙是两套实验室制乙醚的装置,选择装置__________最合适,理由是______________________________。
(2)反应液中应加入沸石,其作用是________________________________________。
(3)反应中温度计的位置应在____________________。
(4)用装置乙制得的乙醚中可能含有大量杂质,这种杂质是__________,除去这种杂质的简易方法是____________________。
(5)如果反应温度太高将会发生__________反应,产物是__________。
为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如下图所示。

请回答以下问题:
(1)测量氢气体积的正确装置是___________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是___________(填写编号)。
A.防止无水酒精挥发 B.保证实验装置不漏气 C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是____________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,量取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为___________,由此可确定乙醇的结构式为___________,而不是______________________。
(5)实验所测定的结果偏高,可能引起的原因是______________________(填写编号)。
A.本实验在室温下进行 B.无水酒精中混有微量甲醇 C.无水酒精与钠的反应不够完全
【化学——化学与技术】
1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。

(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、 。
②检查好装置的气密性后加热B前必须进行的操作是 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
装置B中可能观察到的现象是 。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):装置B中可能观察到的现象是 。
2008年9月,三聚氰胺污染牛奶事件,在社会上造成了很坏的影响。牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,为测定三聚氰胺的组成,用下列各仪器装置,再过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:

 (1)产生的氧气按从左向右流向,所选装置的连接顺序为:
(1)产生的氧气按从左向右流向,所选装置的连接顺序为: D接 、 、 、 、 。
D接 、 、 、 、 。 (2)装置C的作用是 ,装置F中CuO的作用是 ;装置D中发生的反应化学方程式是 。
(2)装置C的作用是 ,装置F中CuO的作用是 ;装置D中发生的反应化学方程式是 。 (3)实验后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为
(3)实验后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为  (4)目前较多采用以尿素为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式)
(4)目前较多采用以尿素为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式)  (5)按(1)的连接方法,此实验装置存在的缺陷是
(5)按(1)的连接方法,此实验装置存在的缺陷是