决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
则,A的化合价 ▲ B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),
其中3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: ▲ ,原因是: ▲ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)某配合物的分子结构如右图所示,
则N原子的杂化方式为 ▲ ;基态Ni原子的电子排布式 ▲ 。
19.(每空2分、共10分)下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格。
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成一种单质气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”).
(2)写出CuH在氯气中燃烧的化学反应方程式:_______________________.
(3)CuH溶解在足量稀盐酸中生成的气体是______(填化学式);该反应的氧化剂是  。(填化学式)
。(填化学式)
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解 在足量稀硝酸中反应的离子方程式:________________________________________.
在足量稀硝酸中反应的离子方程式:________________________________________.
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下 列问题:
列问题:
(1)X的化学式为___ __,D的原子结构示意图为___ __。
(2)元素的非金属性C______ E(填“>”、“<”或“=”)。
下列各项中,能说明这一结论的事实有_____ _(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)BC和BC2气体可用纯碱溶液吸收,有关化学方程式为:
2 BC2+Na2CO3=NaBC2+NaBC3+CO2↑
BC+BC2+Na2CO3=2NaBC2+CO2↑
① 配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
② 现有1000g质量分数为21.2%的纯碱吸收液,吸收BC和BC2混合气体,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
(a)计算吸收液中NaBC2和NaBC3物质的量之比。
(b)1000g质量分数为21.2%的纯碱吸收液在20℃经充分吸收BC和BC2混合气体后,蒸发掉688g水,冷却到0℃,最多可析出NaBC2多少克?(0℃时,NaBC2的溶解度为71.2g /100g水)
(14分)氮是地球上极为丰富的元素,氮元素可形成多种离子,如:N3—、N3—、NH2—、NH4+、N2H5+、N2H62+等。
(1)请画出氮的原子结构示意图___________。
(2)氮的常见氢化物的结构式为________,其空间构型为_______,它极易溶于水的主要原因是_________________,溶于水后显碱性的原因是_______________(用离子方程式说明)
(3)X+中所有电子正好充满K、L两个电子层,它与N3—形成的晶体结构如图26题 l所示。与同一个N3—相连的X+有________个,X的元素符号是________。
(4)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCI相似的晶体结构。图26题-2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是_______________。
有分别含有A、B、C、D、E、F的六瓶无色溶液,这六种溶质均是中学化学中常用的无机试剂。已知纯E为无色油状液体,溶于水时会放出大量热;B、C、D和F是常见金属的盐,且它们的阴离子均不同。现进行如下实验:
①A的溶液有刺激 性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A的溶液分别加入其它五种物质的溶液中,只有溶有D、F的溶液中有白色沉淀产生;继续加入过量A溶液时,D中沉淀无变化,F中沉淀完全溶解;
③将B的溶液分别加入C、D、E、F的溶液中,含C、D、F的三种溶液中均产生沉淀,E溶液中有无色、无味气体逸出;
④将C的溶液分别加入D、E、F中,均有白色沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,请回答下列问题:
(1)确定化学式A C . E
(2)写出F中沉淀完全溶解的化学方程式 。
(3)B在溶液中电离出的阴离子为 (填化学式),能否确定B在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。 。
(4)D在溶液中电离出的阴离子为 (填化学式),能否确定D在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。 。
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下: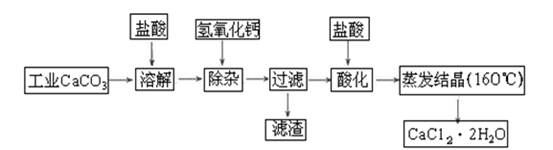 (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
________________________________________________________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________________;
(3)测定样品中Cl-含量的方法是:
a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中需用溶液润洗的仪器有__________________ ______________,
______________,
②计算上述样品中CaCl2·2H2O的质量分数为________________;
(4)已知t℃时,纯水中c(H+)=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积[Ksp[Mg(OH)2]=3.2×10- 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
 (10分)X、Y、Z、W
(10分)X、Y、Z、W 是元素周期表前四周期中的四种常见元素,其相关信息如下表:
是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相 关 信 息 |
| X |
X的基态原 子核外3个 子核外3个 能级上有电子,且每个能级上的电子数相等 能级上有电子,且每个能级上的电子数相等 |
| Y |
Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Y元素基态原子的电子排布式为 。
(2)Y的简单离子半径 Z的简单离子半径(选填“>”、“=”、“<”)。
Z的简单离子半径(选填“>”、“=”、“<”)。
(3)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是  。
。
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为  色。反应过程中涉及的离子方程式为:
色。反应过程中涉及的离子方程式为:  、 。
、 。
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
| |
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
⑥ |
[ |
⑦ |
|
| |
⑧ |
|
⑨ |
|
|
|
|
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区元素的是 (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见溶剂的化学式为 ,其立体构型为_ _______________。
_______________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与元素①形成的最简单分子X属于 分子(填“极性”或“非极性”)。
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为 。
(6)元素⑩的基态原子核外电子排布式是 。
(7)某些不同族元素的性质也 有一定的相似性,如上表中元素②与元素
有一定的相似性,如上表中元素②与元素 ⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
_______________________________________________。
(1)在同一个原子中,离核越近、n越小的能层中的电子能量越 。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和 。现代物质结构理论证实,原子 的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
(2)写出下列基态原子的简化电子排布式:
①14Si ;②26Fe 。
(3)按所示格式填写下表中的空格:
| 原子序数 |
原子的价电子排布式 |
周期 |
族 |
| 17 |
|
第三 |
|
| |
3d54s1 |
|
ⅥB |
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的
键更稳定(填“σ”或“π”)。
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,配离子 [Cu(NH3)4]2+的配体是 。
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为 ,孤电子对数为 ,价层电子对数为 ,中心原子的杂化方式为 杂化,VSEPR构型为 ,分子的立体构型为  。
。
②BF3分子中,中心原子的杂化方式为  杂化,分子的立体构型为 。
杂化,分子的立体构型为 。
X、Y、Z、W、V为前四周期常见的五种元素,其中四种为短周期元素。X原子核外电子数等于其电子层数;常温常压下,Y单质固体难溶于水而易溶于CS2;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
请回答下列问题:
(1)写出实验室通过加热制备z单质的离子方程式 ;
(2)W的两种常见氧化物中阳离子和阴离子个数比为2:1的是 (写化学式);
(3)写出X、Y、W三种元素组成的化合物的水溶液与Z单质反应的离子方程式 (可不配平);
(4)检验V的最高价简单离子常用的试剂是 ;
(5)将12gY单质完全燃烧的产物通入100mL 1.2mol.L-1的氢氧化钠溶液中,所得溶液中含有的主要离子分别是 。
(14分) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)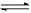 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:(1)该反应的化学平衡常数K =  。
。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)="0.01" mol/L, c(H2O)="0.03" mol/L, c(CO2)="0.01" mol/L, c(H2)="0.05" mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 , H2的转化率为 。
Ⅰ肉桂醛(C9H8O)是一种常用香精,在食品、医药化工等方面都有应用。肉桂醛与其他有机物具有如下转化关系,其中A为一氯代烃。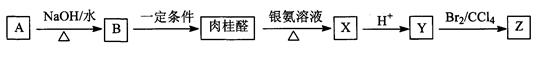
(1)肉桂醛是苯的一取代物,与H2加成的产物中没有支链,肉桂醛结构简式是_______。
(2)反应A→B的化学方程式是_____________________________________________。
(3)Z不能发生的反应类型是(填字母)___________。
a. 取代反应 b. 加聚反应 c. 加成反应 d. 消去反应
(4)Y与乙醇在一定条件下反应的化学方程式是__________________________________。
(5)写出符合下列条件的Y的一种同分异构体的结构简式:
___________________________________________________________________。
①属于酯类 ②苯环上只有一个取代基 ③能发生银镜反应。
Ⅱ葡萄糖不仅是重要的营养物质,而且是重要的工业原料。某厂按如下转化关系生产葡萄糖及其相关产品。
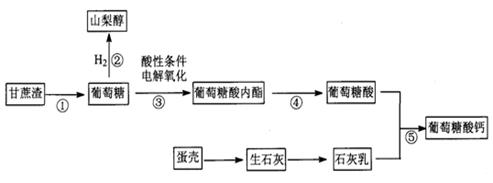
(1)山梨醇的分子式是_____________。
(2)反应③生成六元环状葡萄糖酸内酯,它在(填“阴”或“阳”)__ ___极生成。
___极生成。
(3)反应④的化学方程式是_______________________________________________。
(4)反应⑤得到葡萄糖酸钙溶液,从该溶液中分离出葡萄糖酸钙晶体的实验操作是加热浓缩、_________、过滤、洗涤、干燥。