[山西]2011-2012学年山西省汾阳市高二10月月考化学试卷
2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( ).
| A.使用光催化剂不改变反应速率 | B.使用光催化剂能增大NO的转化率 |
| C.升高温度能加快反应速率 | D.改变压强对反应速率无影响 |
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是( )
SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是( )
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1 mol SO3的同时生成1 mol NO2 |
下列关于热化学反应的描述中正确的是
| A. | 和 反应的中和热 ,则 和 反应的中和热 |
| B. | 的燃烧热是283.0 ,则 反应的 |
| C. | 需要加热才能发生的反应一定是吸热反应 |
| D. | 1 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
在体积可变的密闭容器中,反应mA(g)+nB(s)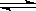 pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )。
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )。
| A.(m+n)必定小于p | B.(m+n)必定大于p |
| C.m必定小于p | D.n必定大于p |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( ).
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( ).
| A.平衡向正反应方向移动了 | B.物质A的转化率增大了 |
| C.物质B的质量分数增加了 | D.a>b |
对于可逆反应4NH3(g)+5O2(g)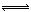 4NO(g)+6H2O(g)下列叙述正确的是( )。
4NO(g)+6H2O(g)下列叙述正确的是( )。
| A.达到平衡时:4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态。 |
| C.达到平衡时,若增加容器容积,则正反应速率减小,逆反应速率增大 |
| D.化学反应的速率关系是:2v正(NH3)=3v逆(H2O) |
在密闭容器中进行如下反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是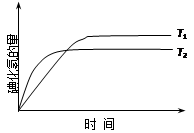
| A.T1>T2,ΔH>0 | B.T1>T2,ΔH<0 |
| C.T1<T2,ΔH>0 | D.T1<T2,ΔH<0 |
在密闭容器中,NO(g)+CO(g) 1/2N2(g)+CO2(g)△H="-373.2" kJ/mol。达到平衡后,为了提高该反应的速率和NO的转换率,采取的措施正确的是( )
1/2N2(g)+CO2(g)△H="-373.2" kJ/mol。达到平衡后,为了提高该反应的速率和NO的转换率,采取的措施正确的是( )
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时通入N2 | D.降低温度同时增大压强 |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:↓,下列各组实验中最先出现浑浊的是
| 实验 |
反应温度/℃ |
溶液 |
稀 | |||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s 后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s 后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是( )。
| A.①③ | B.②③ | C.①④ | D.③④ |
可逆反应:3A(g) 3B(?)+C(?)(ΔH>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( ).
3B(?)+C(?)(ΔH>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( ).
| A.B和C可能都是固体 |
| B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 |
| D.达平衡时升温,逆反应速率减小 |
能用能量判据判断下列过程的方向的是( ).
| A.水总是自发地由高处往低处流 |
| B.放热反应容易自发进行,吸热反应不能自发进行 |
| C.有序排列的火柴散落时成为无序排列 |
| D.多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大 |
反应A(g)+3B(g)  2C(g) △H<0,达到平衡后,将气体混合物的温度降低,下列叙述中
2C(g) △H<0,达到平衡后,将气体混合物的温度降低,下列叙述中
正确的是( ).
| A.正反应速率加大,逆反应速率减小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率减小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率减小,平衡向逆反应方向移动 |
已知热化学方程式2SO2(g) + O2(g)  2 SO3(g) △H = -Q kJ/mol(Q>0),则下列说法
2 SO3(g) △H = -Q kJ/mol(Q>0),则下列说法
正确的是( ).
| A.2 mol SO2(g)和1 mol O2(g)所具有的内能小于2 mol SO3(g)所具有的内能 |
| B.将2 mol SO2(g)、1 mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量 |
| C.升高温度,平衡向正反应方向移动,上述热化学方程式中的Q值减小 |
| D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2 mol SO2(g)被氧化 |
在一定温度下,将1 mol N2和3 mol H2放入恒容密闭容器中,达到平衡时,测得NH3为0.8 mol,如果此时再加入1 mol N2和3 mol H2,达到新平衡时,NH3的物质的量( ).
| A.等于8 mol | B.等于1.6 mol | C.大于0.8 mol小于1.6 mol | D.大于1.6 mol |
将1 mol X、3 mol Y充入一个密闭容器中,在一定条件下发生如下反应并达到平衡: X(g)+3Y(g)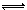 2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( ).
2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( ).
| A.升高温度,X的体积分数减小 |
| B.缩小体积,Y的物质的量浓度不变 |
| C.保持容器体积不变,充入一定量的稀有气体,Z的浓度不变 |
| D.保持容器压强不变,充入一定量的稀有气体,平衡向正反应方向移动 |
将固体NH4I置于密闭容器中,在一定温度下发生下列反应: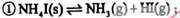
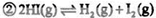
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
| A.9 | B.16 | C.20 | D.25 |
已知C2H4(g)和C2H5OH(1)的燃烧热分别是-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
| A.-44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 编号 起始状态(mol) 平衡时HBr(g) 物质的量(mol) |
| C.-330 kJ·mol-1 | D.+330 kJ·mol-1 |
(14分) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)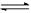 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:(1)该反应的化学平衡常数K =  。
。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)="0.01" mol/L, c(H2O)="0.03" mol/L, c(CO2)="0.01" mol/L, c(H2)="0.05" mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 , H2的转化率为 。
、已知可逆反应: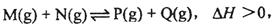
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol,L-1, c(N)="2.4" mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol,L-1, c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a= (要求写出计算过程) ;
(4)若反应温度不变,反应物的起始浓度为:c(M)=" c(N)=b" mol,L-1,达到平衡后,M的转化率为
(要求写出计算过程)。
反应  过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。
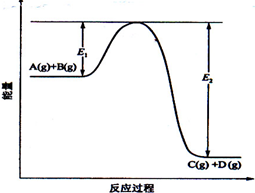
(1)该反应是反应(填"吸热""放热");
(2)当反应达到平衡时,升高温度,的转化率(填"增大""减小""不变"),原因是;
(3)反应体系中加入催化剂对反应热是否有影响?,原因是:
(4)在反应体系中加入催化剂,反应速率增大,和的变化是:,(填"增大""减小、""不变")。
 2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。 粤公网安备 44130202000953号
粤公网安备 44130202000953号