某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,通过计算回答:
(1)依据题意求混合气体的平均相对分子质量,烷烃是什么,烯烃的分子式。
(2)写出混合气体中气态烯烃可能的结构简式:______________。
(1)4HCl(浓) + MnO2 MnCl2 + Cl2↑ + 2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
MnCl2 + Cl2↑ + 2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
(2)把___________ g NaOH固体溶解在90 g H2O中,才能使每10个水分子中含有1个Na+,这时所得溶液中NaOH的质量分数为___________。
将0.1mol某烃的衍生物与标准状况下4.48L氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了3.6g,通过澄清石灰水时,可得到沉淀10g (干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出有机物的结构式。
把铝、铁混合物 1.1 g 溶于200 mL 5 molL -1 盐酸中,反应后盐酸的浓度变为4.6 molL -1 (溶液体积变化忽略不计)。
求:(1)反应中消耗HCl的物质的量。
(2)该混合物中铝、铁的物质的量。
mg铁与一定量水蒸气在高温条件下充分反应,测得生成氢气8.96L,将所得固体混合物完全溶解于足量盐酸,又放出氢气2.24L(气体体积均己折算为标况下),向所得溶液中滴加KSCN溶液,溶液颜色无明显变化。计算:
(1)铁与水蒸气反应时生成的氧化产物质量是多少?(2)最初所用铁粉的质量是多少?
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。求原混合物中单质铁的质量。
为测定某碳酸钠样品的纯度,取一定质量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况下)。计算:
(1)该碳酸钠样品中碳酸钠的质量是。
(2)盐酸的物质的量浓度是。
碳酸氢钠受热易分解为碳酸钠。现加热5.00 g 碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,求①生成CO2多少L(标准状况)? ②原混合物中碳酸钠的质量分数是多少?
按要求回答下列问题:
(1)设NA为阿伏加德罗常数,一个Cl2分子的质量为 g;水煤气(CO和H2的混合物)中含氢气的体积分数约为75%、CO的体积分数约为25%,则该水煤气的平均摩尔质量约为 。
(2)质量分数为29.8%的KCl溶液,其密度为1.15g/cm3,则500mL该溶液中KCl的物质的量为 。
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
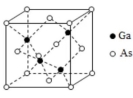
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
0.1mol某烃的衍生物与0.35mol氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了5.4g,通过足量澄清石灰水时,可得到沉淀20g(干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入足量澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出该有机物可能的结构简式和名称。
将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)按顺序写出OA 段所发生反应的离子方程式_______________________。
(2)加人35mL盐酸时,产生二氧化碳的体积为___________mL
(3)计算原混合物中Na2CO3的质量(要求写出计算过程)