常温下0.1mol/L碳酸溶液中,下列离子关系式正确的是
| A.c(H+)="2" c(CO32-)+c(OH-) |
| B.0.1= c(HCO3-)+2c(CO32-) |
| C.c(OH-)= c(H+) - c(HCO3-)-2 c(CO32-) |
| D.c(H+)>c(CO32-) > c(HCO3-) |
某密闭容器中充入等物质的量A和B,一定温度下发生反应: A(g)+xB(g)  2C (g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法正确的是
2C (g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法正确的是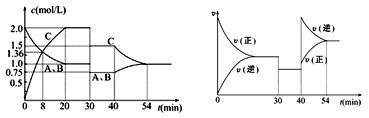
| A.30 min时降低温度,40 min时升高温度 |
| B.反应方程式中x=1,正反应为放热反应 |
| C.该反应在第8 min时达到化学平衡状态 |
| D.30~40 min间该反应使用了催化剂 |
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO )、c(HCO3-)都减少,其方法是
)、c(HCO3-)都减少,其方法是
| A.通入二氧化碳气体 | B.加入饱和石灰水溶液 |
| C.通入氯化氢气体 | D.加入氢氧化钠固体 |
室温下,若溶液中由水电离产生的c(H+)·c(OH-)=1×10-28mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
| A.Na+、I-、Cl-、NO3- | B.K+、Ba2+、Cl-、NO3- |
| C.K+、Na+、Br-、F- | D.Fe3+、Na+、NO3-、SCN- |
某固定体积的密闭容器中,加入一定量的A达化学平衡:aA(g)  bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是
| A.若a=b+c时,B的物质的量分数变大 | B.若a=b+c时,B的物质的量分数不变 |
| C.若a>b+c时,A的转化率不变 | D.若a<b+c时,A的转化率变大 |
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图:( )
下列对该化合物叙述正确的是( )
| A.属于芳香烃 | B.属于卤代烃 |
| C.在一定条件下不能氧化 | D.在一定条件下可以发生加成反应 |
下列离子方程式中书写正确的是( )
| A.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑ |
| B.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O |
| C.铜和硝酸银溶液反应:Cu+Ag+===Cu2++Ag |
| D.硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-===Mg(OH)2↓ |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,1 NA 个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol·/L的MgCl2溶液中,含有Cl-个数为1 NA |
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调合香精。松油醇结构如右图所示,下列有关松油醇的叙述正确的是( )
| A.松油醇的分子式为C10H20O |
| B.松油醇能发生加成反应、消去反应、氧化反应、酯化反应 |
| C.松油醇存在酚类的同分异构体,分子中有2个手性碳原子 |
| D.松油醇分子在核磁共振氢谱中有7个吸收峰 |
设NA为阿伏加德罗常数的值,下列叙述中,正确的是( )
| A.0.1mol·L-1氢氧化钠溶液中含钠离子数为0.1NA |
| B.7gCnH2n中含氢原子数为NA |
| C.1mol C5H12分子中共价键总数为13NA |
| D.标准状况下,2.24L NH3和CH4的混合气体,所含电子总数为2NA |
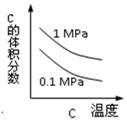
在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g) xC(g);∆H=?符合下图(a)所示的关系w(c)为C的质量分数,由此推断关于图(b)的说法正确的是
xC(g);∆H=?符合下图(a)所示的关系w(c)为C的质量分数,由此推断关于图(b)的说法正确的是
| A.P3>P4,y轴表示A的转化率 |
| B.P3<P4,y轴表示B的体积分数 |
| C.P3<P4,y轴表示混合气体的平均相对分子质量 |
| D.P3>P4,y轴表示混合气体的密度 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.标准状况下,22.4LH2O含有的分子数为 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为 NA |
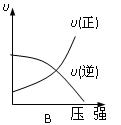
对于可逆反应:2A(g)+B(g)  2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是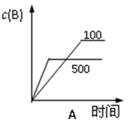
某温度下,密闭容器中发生反应 a X (g)  b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数:a>b+c | B.压缩容器的容积时,υ正增大,υ逆减小 |
| C.达到新平衡时,物质X的转化率减小 | D.达到新平衡时,混合物中Z的质量分数增大 |
已知,H2(g) +I2(g)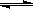 2 HI(g)DH <0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2 HI(g)DH <0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲降低温度,乙不变 | B.甲中加入0.1molHe,乙不改变 |
| C.甲、乙提高相同温度 | D.甲增加0.1mol H2,乙增加0.1mol I2 |