下列仪器中,不属于定量仪器的是
| A.容量瓶 | B.温度计 | C.烧杯 | D.秒表 |
下列微粒间的作用力中,不属于化学键的是
| A.分子间作用力 | B.金属键 | C.共价键 | D.离子键 |
从化学试剂商店购买的某些试剂瓶上常贴有危险化学品的标志。盛装浓硫酸的试剂瓶上所贴的危险化学品标志是
下列有关实验现象或结论的描述不正确的
| A.铅蓄电池充电时,阳极的反应为:PbSO4+2H2O+2e-=PbO2+SO42-+4H+ |
| B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ |
| C.常温下将5mL0.1mol/LNa2S2O3溶液、5mL0.01mol/LNa2S2O3溶液分别与5mL0.1mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响 |
| D.处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气) 2SCl2(鲜红色液体) ΔH=-61.16 kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体) ΔH=-61.16 kJ·mol-1。下列说法正确的是
| A.增大压强,平衡常数将增大 |
| B.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2 |
| C.达到平衡时,若升高温度,氯气的百分含量减小 |
| D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.CO32-、Al3+一定不存在,K+可能存在 |
| C.SO42-、NH4+一定存在,Cl-可能不存在 |
| D.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1 |
下列说法正确的是
A.将标准状况下的2.24L CO2通入150mL 1mol·L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-)
B.常温下0.1 mol·L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
C.0.1 mol·L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
D.室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c (H+) + c(HA)
W、X、Y、 Z、 Q是五种常见的短周期主族元素,原子序数依次增大,在周期表中W原子半径最小;X元素原子核外电子总数是其次外层电子数的3倍;W和Y,X和Z均位于同一主族;Q的非金属性在同周期元素中最强。下列说法正确的是
| A.简单离子半径:Y>Q |
| B.Q分别与X、Z形成的最简单化合物中化学键类型相同 |
| C.YW能与WQ发生复分解反应 |
| D.最简单气态氢化物的稳定性:X<Z |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.Fe在少量C12中燃烧生成0.5 mol产物,转移的电子数为1NA |
| B.78g Na2O2晶体中含有的阴离子数目为2NA |
| C.在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA |
| D.pH=13的NaOH溶液中含有的OH-的数目为0.1NA |
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| B |
将SO2和CO2气体分别通入水中至饱和,立即用pH计测两溶液的pH |
前者的pH小于后者 |
H2SO3酸性强于H2CO3 |
| C |
铝热剂溶于足量稀盐酸再滴加KSCN溶液 |
未出现血红色 |
铝热剂中不能确定是否含有铁的氧化物 |
| D |
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入几滴新制Cu(OH)2悬浊液,加热 |
没有红色沉淀生成 |
淀粉没有水解成葡萄糖 |
短周期元素X、Y、Z、W的原子序数依次增大,W与X同主族,Y的最外层电子数是电子层数的3倍,Y与W核外电子数相差6,Z的最外层电子数等于电子层数。下列说法正确的是
| A.X、Y、W元素的原子半径依次递增 |
| B.X、Z、W元素的最高价氧化物的水化物的酸性依次递增 |
| C.X、W分别与Y形成化合物在常温下均为气态 |
| D.Z、W分别与Y形成的化合物均可作为耐高温材料 |
根据下图所给信息,得出的结论正确的是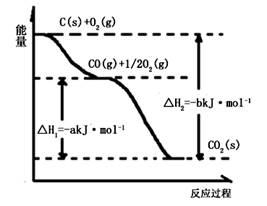
| A.碳的燃烧热为b kJ/mol |
| B.2C(s) + O2(g)=2CO(g) △H=-2(b-a) kJ/mol |
| C.2CO2(s)=2CO(g)+O2(g) △H=+a kJ/mol |
| D.C(s) + O2(g)=CO2(g) △H<-b kJ/mol |
已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+1/2O2(g)=CO(g) ΔH=Q中Q等于
| A.-(a-b) kJ·mol-1 | B.-(a+b) kJ·mol-1 |
| C.-(5a-0.5b) kJ·mol-1 | D.-(10a-b) kJ·mol-1 |
下列有关甲苯的实验事实中,能说明苯环对侧链的性质有影响的是
| A.甲苯能与浓硝酸反应生成三硝基甲苯 |
| B.甲苯能使酸性高锰酸钾溶液褪色 |
| C.甲苯燃烧产生带浓烈的黑烟的火焰 |
| D.1 mol甲苯能与3 mol H2发生加成反应 |