某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3。
(1)“酸浸”过程中发生的主要反应的离子方程式为 。为提高“酸浸”时铝浸出率,可采取的措施之一是 。
(2)“氧化”的目的是 。检验Fe3+已水解完全的方法是 。
(3)滤渣Ⅱ的主要成分是CaCO3、Mg(OH)2和 。
(4)①上述流程中可循环利用的物质的化学式是 。
②“转化”时主要反应的离子方程式为 。
(5)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH)3,从氧化后的溶液开始,若只用纯碱一种试剂,后续操作是 。
市售乙醛通常为40%左右的乙醛溶液。久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液。据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:
(C2H4O)n nC2H4O。
nC2H4O。
(1)先把混合物分离得到(C2H4O)n:将混合物放入____中,静置,分离操作名称为______。
(2)证明是否已有部分乙醛被氧化的实验操作和现象是______________。
(3)提取乙醛的装置如图:烧瓶中放的是(C2H4O)n和6mol/LH2SO4的混合液,锥形瓶中是蒸馏水。加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中。
①用冷凝管的目的是________,冷凝水的进口是_____(填“a”或“b”)。
②锥形瓶内导管口出现气泡,从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛具有___的性质,当观察到导气管中气流很小时,必要的操作是_____,目的是__________。
粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如图:
已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式 。
(2)操作a为冷却、研磨,其中研磨的目的是 。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为 。
(4)操作b的名称是 ,所用的玻璃仪器有 、 和烧杯。
(5)“碳化”时生成沉淀的化学式为 。
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀 (填操作名称)、洗涤、烘干、称量、计算。洗涤沉淀的具体操作是 。
方案二:把一定量的样品与足量硫酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用 。下图装置中实验仪器a的名称是 。

方案三:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。

(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”)。
(2)装置A中试剂X应选用 。
(3)E装置的作用是 。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为 (结果保留小数点后一位)。
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,方方同学认为产生的气体除SO2外,还可能产生氢气。该同学为了验证他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答:
(1) E中加入的试剂是碱石灰,作用是_____________;装置A、B之间的酸性高锰酸钾溶液的作用是_________________;
(2)上述反应中生成二氧化硫的化学方程式为___________________________________;
(3)如果去掉装置B,就不能根据D中的现象判断气体X中有氢气,原因是:_______________________。
(4可以证明气体X中含有氢气的实验现象是:
C中______________________________,D中_______________________。
50mL0.50 mol·L-1盐酸与50mL0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)右图装置名称为____,图中尚缺少的一种玻璃用品名称是_____。
(2)烧杯间填满碎纸条的作用是_______。
(3)实验中改用60mL0.50 mol·L-1盐酸与50mL0.55 mol·L-1NaOH溶液进行反应,与上述实验相比较,所放出的热量_____(填“相等”或“不相等”),中和热______(填“相等”或“不相等”),理由是______。
(4)用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值与57.3kJ / mol 相比较会_____。(填“偏大”“偏小”或“无影响”)。
(5)完整地做一次这样的实验,需测定___次温度。
(6)大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大”、“偏小”或“无影响”)
含苯酚的工业废水的方案如下图所示:
回答下列问题:
(1)设备①进行的是 操作(填写操作名称),实验室这一步操作所用的仪器是 。
(2)由设备②进入设备③的物质A是 。
(3)在设备③中发生反应的化学方程式为 。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、 和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、 。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是 。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4。某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:

试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是 、 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中的 、 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、 。
(4)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是 。
(5)写出第②、③步涉及的两个化学反应的离子方程式: 、 。
请完成下列物质的分离提纯问题。
Ⅰ、现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______,沉淀B 。
(2)证明AgNO3加过量的实验方法是 。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ、某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:(填编号字母) 。
(2)设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。(3)最后碘的CCl4是通过 获得(填“漏斗上口”或“漏斗下口”)。从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有 处。
(4)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。

草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的CO32-、SO42-和Cl-。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在SO42-。③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl-。其中,加入足量Ba(NO3)2溶液的目的是 。
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
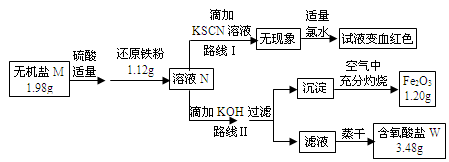
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
天然海水中含有非常丰富的化学元素,具有很大的利用价值。工业上对海水资源综合利用的部分工艺流程如下图所示。
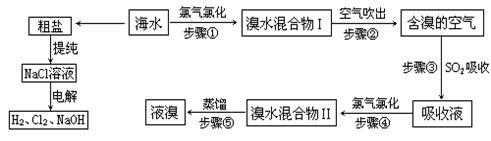
(1)请列举海水淡化的两种方法: 、 。
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入少量二氧化碳发生反应的离子方程式 。
(3)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如上图。步骤①反应的离子方程式是 ;步骤③通入二氧化硫的目的是 ,其反应的化学方程式是 。
(4)步骤⑤蒸馏的过程中,温度应控制在80-90℃。温度过高或过低都不利于生产,请解释其原因: 。
常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量。查阅资料得知:

一种常用的分析试剂 EDTA二钠盐(用Na2H2Y•2H2O表示)可用于测定Ca2+,其反应为:
Ca2++H2Y2-===CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色。于是该实验小组做了如下实验:
步骤一:配制待测溶液。取适量补钙片研碎后,准确称取0.400 g配成250 mL溶液。
步骤二:滴定。用移液管取待测液25.00 mL于锥形瓶中,加入适量NaOH溶液,摇
匀,再加入铬黑T指示剂3滴,用0.0100 mol•L−1EDTA二钠盐溶液滴定至终点。
三次重复滴定平均消耗EDTA二钠盐溶液22.50 mL。
请回答下列问题:
(1)步骤一中补钙剂要用2 mol/L的盐酸溶解,反应的离子方程式为__________________,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有_______、________,操作的先后顺序为:e→____→____→d→f→____→____→____(填下列操作的序号)。
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为_______。
(3)下列操作会导致测定结果偏高的是_______(填下列选项的字母序号)。
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗
铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.7500g试样中加入100.00 mL 0.1200mol/mol KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.1000mol/molFeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1gKI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-=2CuI↓+I2。用0.05000mol/molNa2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2 2I-+S4O62-),消耗14.00 mL。
2I-+S4O62-),消耗14.00 mL。
已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=___________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将___________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
氯化铁是常见的水处理剂。某氯化铁(FeCl3·6H2O)样品含有少量FeCl2杂质。现要测定其中FeCl3·6H2O的质量分数,实验按以下步骤进行:
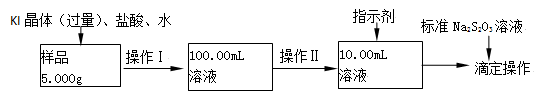
已知有关离子方程式为:2Fe3+ +2I-==2Fe2++ I2 , I2+2S2O32-==2I- +S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻液体呈现红褐色,反应的离子方程式为: 。
(2)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(3)操作Ⅱ必须用到的仪器是 (选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
(4)指示剂是淀粉溶液,则达到滴定终点的现象是 。
(5)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3 溶液18.17mL。该样品中FeCl3·6H2O的质量分数为 。
(6)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是 (选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水