均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是 。
(3)B分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”) 。
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu的基态原子电子排布式为 。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子。
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 。
(10分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。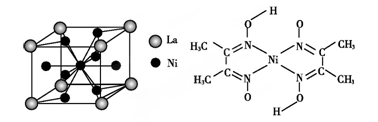
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
[化学——选修3: 物质结构与性质]Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。
(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
(4)锡的某种氧化物的晶胞如图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度为 。
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Y元素在周期表中的位置是___________ __。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________;U的氢化物的标准燃烧热为-890.31kJ·mol-1,请写出其燃烧的热化学方程式:
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构。
(1)有一种由铝、铜、铁三种元素构成的天然准晶体化合物,分析该准晶体组成的一种简单方法是先将该准晶体进行粉碎,然后按如下程序进行实验:
第1步:称取38.99 g 准晶体,让其与足量的NaOH溶液充分反应,在标准状况下,收集得到21.84 L 氢气。
第2步:将第1步反应后的浊液过滤出固体,用蒸馏水洗涤,逐滴滴入6mol/L盐酸,当加入的盐酸的体积为40mL时,固体不再溶解。
①铝、铁的第一电离能的大小关系为 (用元素符号表示)。
②根据以上实验可确定该准晶体的化学式为 。
(2)锰与一种短周期元素A形成的凝固态是一种准晶,已知A最外层电子数等于其电子层数,且其中含有成对和不成对电子。
①锰原子在基态时的核外电子排布式为 。
②锰与A在准晶体中的结合力为 。(离子键、共价键、金属键、分子间作用力)
③锰与A形成的准晶结构如图所示,则该准晶体的化学式为 。
④过渡金属配合物Mn2(CO)n的中心原子价电子数与配体提供电子总数之和为34,则n= 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
21.A.《物质结构与性质》
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。

⑴基态Ga原子的电子排布式可表示为 ;
⑵5-氨基四唑中所含元素的电负性由大到小的顺序为 ,其中N原子的杂化类型为 ;在1 mol 5-氨基四唑中含有的σ键的数目为 。
⑶叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为 。
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3)X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种,)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
【化学—选修3:物质结构与性质】
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3) 向CuSO4溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数与未成对电子数相等,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
⑴A、B、C的第一电离能由小到大的顺序为 。
⑵D与E的原子化热分别为340 kJ·mol-1和125 kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
⑶分子A2B2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有 键的数目为 。
键的数目为 。
⑷基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
⑸D的氢化物的晶体结构如右图所示,其化学式是 ,图中白球构成的晶体结构是由 (填“密置层”或“非置密层”)按一定的方式在三维空间堆积形成的,写出此氢化物在氯气中燃烧的化学方程式 。
A、B、C、D、E、F、G为前四周期元素。A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子。
(1)元素B、C、D的第一电离能由大到小的顺序为 (用元素符号表示)。
(2) ED3分子的空间构型为________,中心原子的杂化方式为________________________。
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是 (填序号)。
(4) CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是________(填序号)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5) EBC-的等电子体中属于分子的有 (填化学式),EBC-的电子式为 。
(6)G的价层电子排布式为________,化合物[G(CA3)6]F3的中心离子的配位数为 。
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:
①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为 。
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为 g.cm-3。
过渡金属元素铁能形成多种配合物,如:Fe(CO)x等。
1.①基态Fe3+的M层电子排布式为 .
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
2.O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm.(用含ρ、NA的计算式表示)

3.下列说法正确的是
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
[化学——物质结构与性质]
物质结构理论有助于人们研究化学反应规律。请回答下列问题:
(1)在第三周期中,第一电离能大于硫的元素有 种;
(2)铜及其化合物在科学研究和工农业生产中有许多用途。
①铜原子价电子排布式为
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为 。该化合物阴离子的化学式为 ;
③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是 。
| A.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键 |
| B.NH3分子的键角小于H2O分子的键角 |
| C.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键 |
| D.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素 |
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如右图乙所示。A的化学式为 ,晶胞中的白点代表的原子是 (填元素名称)。
[化学一物质结构与性质](13分)钛被称为“国防金属’’和“生物金属”,是重要的结构材料。
(1)基态钛原子的核外电子排布式是_______________________________,钛所在的周期中第一电离能最小的元素是______________________________.
(2)金红石(TiO2)的熔点 ,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
(3)TiCl4能与NH4CI反应生成配合物(NH4)2[TiCl6]。此配合物中,形成配位键时提供孤对电子的有_____________.(填元素符号),空间构型呈正四面体的微粒是___________。
(4)TiO2+与H2O2在稀酸中反应生成橘红色的[TiO(H2O2) ] 2+离子,可用于钛的定性检验。
[TiO(H2O2) ] 2+中不含有_____________________________.
A.极性键
B.非极性键
C. 键
键
D. 键
键
E.离子键
(5)H2O2分子可看成H2O分子中的一个H被OH所取代,下列关于H2O2的说法正确的是______
A.H2O2分子结构对称为非极性分子
B.I mol H2O2最多能形成2mol氢键
C.H2O2不稳定是因为氢键的键能较小
D.H2O2分子的空间构型为直线形
( 12分)有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(1)已知BA5 为离子化合物,是由 、 两种微粒构成的(填化学符号)。
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了 。
(4)G位于 族,G3+价电子排布式为 。GE3常温下为固体,熔点 ,沸点
,沸点 ,在
,在 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
(5)DE3 中心原子的杂化方式为 ,其空间构型为 。
(6)前四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式) ,原因是
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素
| |
|
|
|||||||||||||||
| a |
b |
|
|
c |
d |
e |
|
|
|||||||||
| f |
g |
h |
|
|
i |
j |
|
||||||||||
| |
|
|
|
|
k |
|
|
|
|
m |
|
|
|
|
|
|
|
试回答下列问题:
(1)d的基态原子电子排布图为 ;k的外围电子排布式为
(2)ci2的结构式为 ;ci2与ce2比较,沸点较低的是 (写化学式)
(3)m的晶体的晶胞如图所示,则一个晶胞中m原子的个数 个。每一个m周围有 个M与其相邻且距离相等。
(4)根据等电子体原理,写出与d2互为等电子体的粒子 、 (写化学式)
(5)下列关于元素在元素周期表中的位置的叙述正确的是 。
A.m位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.k位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.g位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.j位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(6)将氨水逐滴滴入到m的硫酸盐溶液中,直至过量,现象 ,若加入极性较小的溶剂乙醇,现象 。写出反应过程中总的离子方程式 。