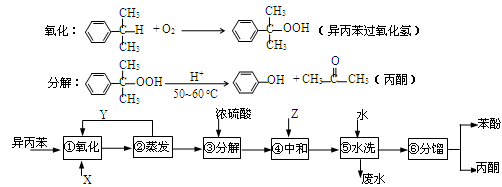
异丙苯( )氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
已知:
完成下列填空:
(1).X物质是 ;Y物质是 。
(2).浓硫酸的作用是 ,其优点是用量少,可能的缺点是 (写一条)。
(3).Z物质最适宜选择 (选填编号)。
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
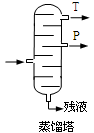
(4).步骤⑥分馏,工业上在分馏塔中进行,如右图,产品T是 ,请说明理由 。
废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶。
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀。加入少许淀粉溶液。
③用0.0250 mol/LNa2S2O3标准溶液滴定至终点。用去Na2S2O3溶液22.48mL。
(5).已知:BrO3–+5Br–+6H+→3Br2 + 3H2O ;写出苯酚与浓溴水反应的化学方程式 ;
第①步加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是 。
(6).已知:I2 + 2Na2S2O3→2NaI + Na2S4O6;滴定终点的现象是 ;该废水中苯酚的浓度是 mol/L(保留4位小数)。
羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①碳酸 ②乙醇 ③苯酚 ④乙酸
I.甲同学设计并实施了如下实验方案,请完成(1)(2)(3)(4)的填空及结论。
| 编号 |
实验操作 |
实验现象 |
结论及解释 |
| 1 |
分别取4种溶液,滴加紫色石蕊溶液 |
溶液变红的是①④溶液 |
略 |
| 2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 |
②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: (1)___________ |
| 3 |
用一定浓度的醋酸溶液浸泡水垢(水垢主要成分为碳酸钙) |
(2)__________ |
略 |
| 4 |
将CO2通入C6H5ONa溶液中 |
(3)__________ |
反应的化学方程式: (4)_____________ |
| 结论: 4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)_____________。 |
II.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)_______中,B管插入E中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_____________溶液的洗气装置,使乙同学的实验设计更加完善。
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

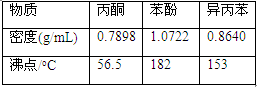
相关化合物的物理常数:
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是_____,优点是用量少,缺点是__________。
(4)反应②为_____(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
阿司匹林的有效成分是乙酰水杨酸(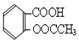 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为: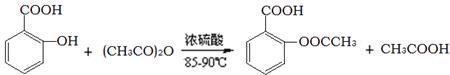
操作流程如下: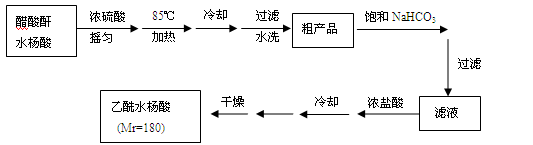
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是 。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式 。
①分批用少量饱和NaHCO3溶解粗产品,目的是 。判断该过程结束的方法是 。
②滤液缓慢加入浓盐酸中,看到的现象是 。
③检验最终产品中是否含有水杨酸的化学方法是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
①写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式 。
②阿司匹林药片中乙酰水杨酸质量分数的表达式为 。
(10分)对叔丁基苯酚( )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。
实验步骤如下:
步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。
步骤2:向X中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为 。
(2)步骤2中发生主要反应的化学方程式为 _________________________ 。
(3)图中倒扣漏斗的作用是 。苯酚有腐蚀性,若其溶液沾到皮肤上可用 洗涤。
(4)下列仪器在使用前必须检查是否漏液的是 (填选项字母)。
| A.量筒 |
| B.容量瓶 |
| C.滴定管 |
| D.分液漏斗 |
E.长颈漏斗
(5)本实验中,对叔丁基苯酚的产率为 。(请保留三位有效数字)
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了下图的实验装置(夹持仪器已略去).
(1)某生检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好.你认为该生的操作正确与否?_________ (填“正确”或“错误”)大理石与乙酸溶液反应的化学方程式为 _________
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 _________ 反应的离子方程式为 _________
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚.改进该装置的方法是 _________ 证明乙酸为弱酸
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,选用适当的仪器和用品,用最简便的实验方法证明乙酸为弱酸 _______ __
(5)在相同温度下,测定相同物质的量浓度
a.NaHCO3溶液 b.Na2CO3溶液 c.CH3COONa溶液 d. ﹣ONa溶液
﹣ONa溶液
的pH,其pH由大到小排列的顺序为 _________ (填溶液编号)