(14分)某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
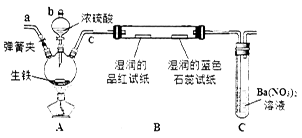
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为________;实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式),原因是___________。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:______________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为 (填序号);装置②的作用是 ;③的作用是 ;然后再进行的操作是从a处多次鼓入N2,原因是_______________。
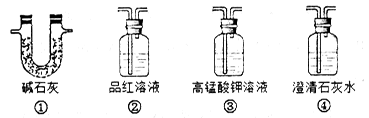
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是________(用离子方程式表示)。
菠菜营养丰富,在营养价值上是一种高效的补铁剂。但因草酸含量高,因而吃起来有涩味。某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁;
②菠菜中草酸及草酸盐的含量(以C2O42-计);
通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水。
他们设计的实验步骤如下:
Ⅰ.取菠菜样品,按如下步骤进行实验,观察实验现象。

Ⅱ.另取一份菠菜样品研磨成汁后,在少量开水中煮沸2~3 min,冷却后过滤得滤液。向滤液中加入足量Ca(OH)2溶液,然后再加入足量试剂X,观察现象。并过滤得CaC2O4固体。
Ⅲ.用稀HCl溶解CaC2O4,并加水配制成100mL溶液.每次准确移取25.00mL该溶液,用0.0100mol•L-1KMnO4标准溶液滴定,平均消耗标准溶液VmL。(不考虑Cl-被KMnO4氧化。)
请回答以下问题:
(1)操作①中使用的仪器除三脚架、泥三角、酒精灯、玻璃棒外,还需要的硅酸盐质仪器 ,操作②的名称是 。
(2)通过资料分析,菠菜中的Fe是+2价还是+3价? 。
步骤I中 (填现象)可以证明该结论?
(3)通过步骤Ⅱ可以确定菠菜中含有草酸类物质。由于滤液中含有CO32-,故需加入试剂X排除CO32-的干扰。
则X是 (写化学式),加入试剂X后可观察到沉淀部分溶解。
(4)步骤Ⅲ中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有 ,该步骤中滴定操作的终点如何判断________________;所涉及的离子反应方程式 。
(5)若样品的质量为W g,则菠菜中草酸及草酸盐(以C2O42-计)的质量分数为___ __。
(14分)已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
(1)装置的连接顺序为 。
(2)饱和食盐水的作用是 。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_______。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是 。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀HCl和BaCl2溶液,产生白色沉淀。
②另取同浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明 ;
实验②的目的是 ;
得出结论:溶液褪色的原因是 。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
(1)该组同学为了制取Cl2,SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,发生装置B应选择三种装置中的___________(选填序号),F的作用是_____________。
(2)D装置中主要反应的离子方程式为__________________________。
(3)为检验通入D装置中的Cl2是否过量,该组同学取适量D溶液滴加至盛有少量紫色石蕊的试管中,若出现___________现象,则Cl2过量,此时E中发生的离子反应方程式为______________________,若D中出现__________________实验现象,则氯气不过量。
某化学兴趣小组用100 mL 1 mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化)。为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验。请帮助他们完成下列相应实验内容。
[提出假设]
假设Ⅰ:溶液A的溶质为NaOH、Na2CO3;
假设Ⅱ:溶液A的溶质为Na2CO3;
假设Ⅲ:溶液A的溶质为Na2CO3、NaHCO3;
假设Ⅳ:溶液A的溶质为 。
[实验过程]
(1)甲同学取少量溶液A于试管,再向试管中滴加几滴酚酞溶液,溶液A变红,由此得出假设I成立。
(2)乙同学分析后认为甲同学的实验结论有误。请用离子方程式说明乙同学的判断依据 ;他进一步提出,应先取少量溶液,向其中加入足量的 溶液,来检验溶液A是否含 ,结果加入检验溶液后观察到溶液A变浑浊。
(3)丙同学为了检验溶液A是否还含其它溶质,他将乙同学所得浑浊溶液进行过滤,并把滤液分为两份,向其中的一份加入稀硫酸,有无色气体生成,则假设 正确。
(4)为准确测定a值,丁同学取了10 mL 溶液A在锥形瓶中,用滴定管向其中加入某浓度的稀硫酸,记录加入硫酸的体积与生成气体的情况,并绘制成如图:
则a= ,所加硫酸的物质的量浓度为 。
某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 gNaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度T3。
得到下表的数据: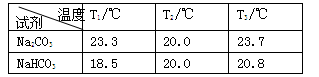
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是 (用离子方程式表示)。
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解_________。
(3)分析表1的数据得出:Na2CO3固体溶于水______,NaHCO3固体溶于水______(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10 mL_____,搅拌,测量温度为22.2℃。
(5)结合上述探究,下列说法正确的是__________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为_____(用代数式表示)。
附表:溶解度表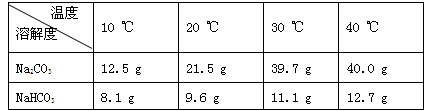
实验:①0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液等体积混合得到浊液,过滤。
②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清。
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解。
下列分析不正确的是
| A.实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl¯ |
| B.实验②证明了该温度下Ag2S比Ag2SO4更难溶解 |
| C.实验③的溶液中含有Ag(NH3)2+微粒 |
| D.由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
实验室制备氯气:MnO2+4HCl(浓) MnCl2+ Cl2↑+2 H2O反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学设计了4组实验方案(每次均量取20 mL反应残余液进行实验),其中正确的是
MnCl2+ Cl2↑+2 H2O反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学设计了4组实验方案(每次均量取20 mL反应残余液进行实验),其中正确的是
| A.与足量AgNO3溶液反应,过滤、洗涤、干燥,称量生成的沉淀质量为a g |
| B.稀释10倍后取20 mL用已知浓度的NaOH溶液滴定,消耗NaOH的体积为b mL |
| C.与足量NaHCO3固体反应,逸出气体用足量碱石灰吸收,增重c g |
| D.加入d1g CaCO3(过量)充分反应后,称量剩余固体质量为d2 g[已知:Ksp( CaCO3)>Ksp( MnCO3)] |
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
它们制备SO2和Cl2所依据的原理分别是:
Na2SO3+H2SO4= Na2SO4+H2O+SO2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)用来制取Cl2的装置是 (填序号),反应中浓盐酸所表现出的化学性质是 和 。
(2)反应开始一段时间后, B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,____ __ (填“B”或“D” )试管中无明显现象。
(3)装置C的作用是 ;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是 。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 44.8℃)
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时溶液酸性增强,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
为测定镀锌铁皮锌镀层的厚度,将镀锌铁皮与足量的盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响,判断正确的是
| A.铁皮未及时取出,会导致测定结果偏小 |
| B.铁皮未洗涤干净,会导致结果偏大 |
| C.把盐酸换成稀硫酸,会导致结果偏大 |
| D.烘干时间过长,会导致结果偏小 |
欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:
请回答:
(1)如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是_______(填字母);
A.稀H2SO4 B.NaOH溶液 C.Ca(OH)2溶液
试管①中发生反应的化学方程式是_________________________。
(2)如乙图所示,试管④中装入的固体应该是_________(填化学式)。
(3)通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性_____(填“强”或“弱”)。
Ⅰ、Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式: 。每2molNa2O2参加反应,转移电子数为 。
Ⅱ、某学生课外活动小组模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
请回答:
(1)图中各装置接口连接顺序是:(填各接口的编号,其中连接胶管及夹持装置均省略)
→ → →⑥ → ⑦ → → →
(2)装置C中放入的反应物是 和 (填化学式)。
(3)装置B的作用是 。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意 (填字母编号)。
a.视线与凹液面最低处相平
b.等待气体恢复常温才读数
c.读数时应上下移动乙管,使甲乙两管液面相平
d.读数时不一定使甲乙两管液面相平
(5)实验测收集的氧气在标准状况下体积为V L,则参与反应的Na2O2的物质的量为 mol。
用图示装置制备NO并验证其还原性。
(1)铜与稀硝酸反应的离子方程式是__________。
(2)滴入稀硝酸之前,应该关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞。这样操作的目的是__________。
(3)滴入稀硝酸后,烧杯中的现象是__________。
(4)烧杯中的反应停止后,打开止水夹,通入__________可验证NO的还原性。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式:______________________________________。
(2)装置A中的烧瓶内固体可选用_________(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D_____________,E 。(均填编号)
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出该反应的化学方程式: ;该反应中每生成0.5molN2转移 mol电子。