研究性学习小组利用下列有关装置进行探究实验,回答相关问题。
(1)写出A中的反应化学方程式
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是 。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有 性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 |
实验操作 |
预期现象与结论 |
| |
|
|
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验。
该小组的实验目的是 。
Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为
2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为 。
(2)C中所盛试剂可能是 ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是 ;该生用如下实验进一步验证黑色物质的组成:

基于上述假设分析,黑色物质的组成为 (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式 ;
②以淀粉为指示剂,则到达滴定终点的现象是 ;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为 。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为: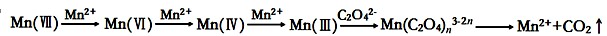
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】
(1)称取 g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间 (s) |
|||
| 0.10mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
|
18 |
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5mL 0.10mol/L K2SO4溶液 |
18 |
则x = ,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式: 。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
| 编号 |
0.02mol/LNaHSO3溶液/mL |
0.02mol/LKIO3溶液/mL |
H2O/mL |
反应温度/℃ |
溶液变蓝的时间t/s |
| ① |
10 |
15 |
a |
10 |
t1 |
| ② |
10 |
40 |
0 |
10 |
t2 |
| ③ |
10 |
b |
0 |
20 |
t3 |
表中a= ,b= 。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应
速率 mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系: 。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二: ;
………………
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
| 实验方案(不要求写出具体操作过程) |
预期实验现象和结论 |
| |
|
已知SO2可以用Fe(NO3)3溶液吸收,某学习小组据此按下图装置展开如下相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为 ;检查图中连通装置A、B气密性的方法是 。
(2)加入浓硫酸之前先通人N2一段时间,其目的是 ;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是 。若用氢氧化钠溶液处理尾气,则发生反应的离子方程式为 。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应。
假设2: 。
假设3:Fe(NO3)2溶液显酸性,在此酸性条件下NO3‾能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
| 实验步骤(简述操作过程) |
预期现象和结论 |
| ①测1.0mol•L‾1Fe(NO3)3溶液的pH; ② ③ ④ |
|
实验室以含有Ca2+、Mg2+、Cl—、SO42—、I—等离子的卤水为主要原料,制备无水CaCl2和I2。流程如下:
(1)操作Ⅰ的方法是 ,所用主要仪器的名称是 。
(2)加入溶液W的目的是除去SO42-。用CaO调节溶液Y的pH,可以除去Mg2+。酸化溶液Z时使用的试剂是______。从溶液V中再得到I2的操作方法是 。
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是 。
(4)模拟以下净化Cl2流程:Cl2 →饱和NaCl溶液 → 浓H2SO4→纯净Cl2
设计合理实验验证H2SO3酸性强于H2CO3。
供选的试剂:CO2、SO2、Na2CO3溶液、NaHCO3溶液、NaHSO3溶液、蒸馏水、澄清石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
SO2→ → → → 。
18.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。
请按要求回答相关问题:
(1)甲烷燃料电池负极的电极反应式是 。
(2)石墨电极(C)的电极反应式为 。
(3)在标准状况下,若有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为 L。
(4)在开始一段时间,铜a电极附近溶液中观察到的现象为 。
(5)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 (填字母)。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现 象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |
铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
| 操作 |
现象 |
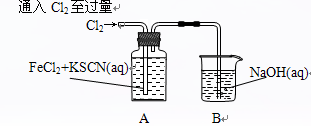 |
现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
(1)B装置中反应的化学方程式____________ _ _______________ _______。
(2)A中溶液变红的原因是____________________ _ _________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_ _。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为 ,
,
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个。
②若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为______极,电极反应式为________________ __。
某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为_____________:实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_____________________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是________________________________。
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是___________________(用离子方程式表示)。
(15分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2•yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
| 实验序号 |
实 验 |
实验现象 |
结 论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
安静燃烧,火焰呈淡蓝色 |
气体成分为 ① |
| 实验Ⅲ |
将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② |
③ |
白色不溶物中含有MgCO3 |
| 实验Ⅳ |
取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 |
产生白色沉淀,溶液红色变浅 |
溶液中存在CO32-离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示:
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是 ;
②白色不溶物的化学式为 。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式
__________________________________________________________________________。
某实验室小组偶然返现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡。为了探究产生此现象的原因,该小组设计实验探究如下:
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程 。饱和NaHCO3溶液pH=8.4,用离子方程式表示 。
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同。表中不要留空格):
| 序号 |
实验操作 |
实验现象 |
实验结论 |
| ① |
将镁条投入5ml蒸馏水 |
微量气泡 |
|
| ② |
将镁条投入5ml饱和NaHCO3溶液中 |
|
Mg与NaHCO3溶液剧烈反应 |
| ③ |
将镁条投入5ml NaOH溶液中 |
现象不明显 |
Mg与NaOH溶液较难反应 |
(3)对于反应②中产生的气体(不考虑水蒸气),请你完成假设二和假设三:
假设一:只有CO2;假设二:只有 ;假设三:
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论。
| 实验步骤 |
想象和结论 |
| 大试管中加入擦去氧化膜的镁条 |
|
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示“步骤二”中溶液变红的原因: 、 。
(2)甲同学探究“步骤二”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
实验III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明 ;
②实验III的目的是 。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol•L-1 的FeCl2溶液,重复“步骤二”中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的原因可能是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现 象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |
某学生为了探究钠与CO2的反应,利用如图装置进行实验.(已知PdCl2能被CO还原得到黑色的Pd)
(1)请将上图各装置连接完整(填写装置中字母):c接f, 接 , 接 , 接 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是 。
| A.NaNO3溶液 | B.CCl4 | C.苯 | D.稀硝酸 |
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。
(4)反应过程中CO2足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体. 。
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留. 。
某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
| 实验内容 |
实验方法 |
实验现象 |
| 验证氧化性 |
|
|
| 验证不稳定性 |
|
|