(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO3- )变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大。4种趋势中可能的是 。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是 。
②分别用pH为0.1的NaOH溶液中和,其中消耗NaOH溶液最多的是 。
③反应开始时,反应速率 。
| A.HCl最快 | B.H2SO4最快 | C.CH3COOH最快 | D.一样快 |
实验题
Ⅰ以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为 。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,仍然无法观察到沉淀产生。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.硫化钠溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为2∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图
含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_________极,其电极反应式为 ;电池的总反应式
Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是 (填序号)
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是 (填序号)
A.铅蓄电池负极的反应式为:Pb—2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
下列实验方法操作,能达到要求的是( )
| A.用托盘天平称量25.20g氯化钠固体 |
| B.用250ml容量瓶配制150mL一定浓度的盐酸溶液 |
| C.用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体 |
| D.过量的铁丝在氯气中点燃,可制取氯化亚铁 |
(10分)某研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验。
(1)取0.98 g Cu(OH)2固体加热,质量随温度变化的曲线如图1所示,产物A、B的化学式分别为 和 。
(2)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为 。
(3)为证明产物A在加热时能与NH3反应,某同学设计了如图Ⅱ(夹持装置未画出)所示实验装置。
①简述检查该装置气密性的方法 。
②实验过程中观察到两个明显现象: i直玻璃管中固体由黑色变为红色;ii装置乙中固体由白色变为蓝色。能证明产物A与NH3发生了反应的判断依据的是 (填选项字母)。
a.只有i可以 b.只有ii可以 c.i或ii都可以
在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉—KI溶液②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。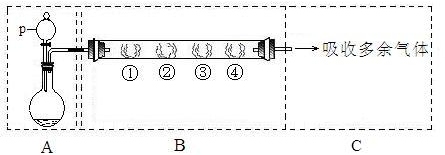
回答下列问题:
(1)p中盛装试剂的名称为 。
(2)反应开始后,观察到的实验现象是:
①处: ;
②处: ;
③处: 。
(3)写出④处反应的离子方式: 。
某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如右图所示装置。实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余。
(1)为防止空气污染,请补画右图虚框中的实验装置,并注明所需要的试剂名称。
(2)写出铜跟浓硫酸反应的化学方程式:
。
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
。
(4)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的 (填写字母序号):
| A.铁粉 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |

(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②
(12分)某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙两套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a—无水乙醇(沸点:78℃);b—铜丝;c—无水硫酸铜;d—新制氢氧化铜悬浊液。

(1)简述两套方案各自的优点:
甲:__________________________________________________________________,
乙:___________________________________________________________________。
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为_________________________________________________________(例如甲①,乙②)。
(3)若要保证此实验有较高的效率,还需补充的仪器有________,理由_______________。
(4)实验中能验证乙醇氧化产物的实验现象是________________________________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式:__________________________________。
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中观察到一些现象,并产生了相关的思考。
(1)向盛KI溶液的试管中滴加氯水,溶液呈棕黄色。如果继续向试管中滴加氯水,充分振荡,溶液逐渐变浅,最后变成无色。写出并配平溶液由棕黄色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)将KI溶液换成KBr溶液,滴加氯水,溶液呈橙黄色;滴加氯水至过量,颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(3)为证明溴单质的氧化性强于Fe3+,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈棕黄色。为了证明棕黄色溶液是由于Fe3+的存在,而不是溴单质颜色所致,应当采取的补充实验是
(4)在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br—被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器.铁架台.试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号) 。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是 。
(3)写出B处的现象 。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由__________ _ _____。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_________________;
(3)该小组在步骤①中的错误是_____________ _ _______,由此造成的测定结果_________(填偏高、偏低或无影响);
(4)步骤②缺少的操作是_______ ___ _;
(5)下图,是某次滴定时的滴定管中的液面,其读数为___________mL;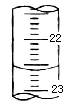
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.40 |
20.38 |
| 第二次 |
25.00 |
4.00 |
24.02 |
请计算待测烧碱溶液的物质的量浓度。(请写出解答过程)
.某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
Ⅰ.装置B的作用 。
装置D的作用 。
Ⅱ.如何检验反应中是否有O2生成
。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: 。
(1)假设2的反应方程式为 。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4。
该方案是否合理 (填“是”或“否”),理由是 。
(3)设计实验验证假设3:取少量C中固体产物于试管中,加入适量的蒸馏水溶解, ,则假设3成立。(写明操作与对应的现象)
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。
(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是__ ______。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为_________;Ⅳ发生反应的化学方程式为________;Ⅴ中的试剂为_____________ 。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ—Ⅳ—Ⅱ—Ⅴ—Ⅵ,此时Ⅱ中现象为___ _____,原因是___ _______________。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为_________ _______。