石油是一种极其重要的资源,是发展国民经济和国防建设重要物资。B的产量通常用来衡量一个国家的石油化工水平,A是生活中常见的有机物,易溶于水并有特殊香味。

Ⅰ.有关物质转化关系如图1所示:
(1)足量烃B通入溴水的实验现象是 。
(2)反应②属于 反应(填有机反应类型)。
(3)写出反应④的化学方程式 。
Ⅱ.某化学兴趣小组对反应③进行探究活动,设计如图2装置进行实验:
(4)在实验中球形干燥管除起冷凝外,另一个重要作用是 。
(5)反应结束后b中的现象是 。
2015年9月20日“长征六号”运载火箭成功将20颗微小卫星送入太空,创造了中国航天一箭多星的新纪录。“长征六号”运载火箭采用无毒环保的过氧化氢一煤油为推进剂。
(1)石油经过 可获得汽油、煤油、柴油、重油等,通过将重油_______可获得更多的汽油、煤油等轻质油。
(2)煤油中的主要组成元素是 (填元素符号)。
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是 (填化学式),每产生1mol气体时转移电子的物质的量为__________。
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):

①在60℃、pH=3.1条件下,H2O2的分解速率为__________mol/(L·min)(已知30%的H2O2溶液的密度为1.11 g/cm3,反应过程中溶液体积变化忽略不计,计算结果保留两位有效数字)。
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为_____________(填标号)。
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
汽油(假设其成分以辛烷计)中加入一定比例的乙醇能提高汽油的燃烧效率,节约能源、减少污染。
(1)加入一定比例乙醇的汽油完全燃烧,比等质量的未加乙醇的汽油完全燃烧,所消耗O2的物质的量 (选填“大”、“小”、“相等”)。
(2)若取22.8 g未加乙醇的汽油,使之完全燃烧,产生的CO2在标准状况下的体积为 。
(3)若取50.2 g掺入乙醇的汽油,与足量O2反应,测得生成CO2的质量为149.6 g。计算所取汽油中乙醇的物质的量是多少?
煤的液化是将煤进行深加工的重要工业过程,请结合下图回答相关问题
(1)煤的液化是将煤转化为 的过程。
(2)煤的液化分为两种分别是 和 ,上图中展示的是 。
(3)该流程中将净化后的氢气和一氧化碳在催化剂的作用下合成 、 及化学品等,该过程中可以循环使用的是 。
(4)这种煤的液化操作条件比较温和,几乎不依赖于煤的种类,关键是 的选择。
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和 。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2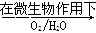 Fe2++SO42-
Fe2++SO42-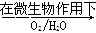 Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ,第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]= ,实际生产要将r值维持在1.7~2.2之间,原因是 。
煤和石油是重要的能源,也是化工生产的重要原料。
(1)工业上分馏石油的设备是________,通过该设备制备出的液体燃油有__________________________。
(2)使用催化剂进行石油裂化及裂解获得的主要产品是_____________________________。
(3)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______ _____________________。
(4)下图是对煤燃烧产生的废气进行常温脱硫处理的流程示意图。
①废气脱硫过程中,主要反应的化学方程式为__________________________、__________________________。
②在煤中直接添加一种物质,可有效减少煤燃烧产生的SO2,该物质是_________________________。
③石膏在工业生产中的用途是________(写出一种用途即可)。
(5)煤经过________(填加工方法)可以得到炉煤气、煤焦油和焦炭。煤焦油经过________(填加工方法)可得到芳香族化合物。煤也可以用氢化法转化成燃油,氢化法的本质是___________________________。
已知煤的近代结构模型如图所示。
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2 Fe2++SO42—
Fe2++SO42— Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和 。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ,
第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:__________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:______________________________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是___________________________________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。