钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为
| A.Fe-2e-=Fe2+ | B.Fe-3e-=Fe3+ | C.O2+2H2O+4e-=4OH- | D.2H++2e-= H2 ↑ |
下列有关金属的腐蚀与防护的说法不正确的是( )
| A.地下钢管连接镁块可以保护地下钢管 |
| B.纯银制品在空气中因化学腐蚀渐渐变暗 |
| C.当镀锌铁制品的镀层破损时,镀层不能对铁制品起保护作用 |
| D.水中的钢闸门连接电源的负极可以保护钢闸门 |
下列叙述的方法不正确的是 ( )
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4OH- |
| C.钢铁在干燥空气中不易被腐蚀 |
| D.用牺牲锌块的方法来保护船身 |
下列物质的有关事实与电化学腐蚀无关的是
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀 |
| D.在空气中,金属镁、铝的表面可形成一层氧化膜 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e—=H2 | B.Fe2++2e—=Fe |
| C.Fe-2e—=Fe2+ | D.O2+2H2O+4e—=4OH— |
下列说法正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.合金都比纯金属易被腐蚀 |
| C.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀 |
| D.钢铁设备上连接铜块可以防止钢铁被腐蚀 |
据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是 ( )
| A.2H+ + 2e— = H2↑ | B.2H2O + O2 + 4e— = 4OH— |
| C.Fe-2e— = Fe2+ | D.4OH—-4e— = 2H2O + O2↑ |
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2,在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
| A.此腐蚀过程有化学腐蚀也有电化学腐蚀 |
| B.发生电化学腐蚀时的正极反应为 2H2O+O2+4e﹣═ 4OH﹣ |
| C.在化学腐蚀过程中有氢气产生 |
| D.发生电化学腐蚀时的负极反应为Fe﹣2e﹣═ Fe2+ |
下列各种方法中,能对金属起到防止或减缓腐蚀作用的是
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥
④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
| A.①②③④ | B.①③④⑤ |
| C.①②④⑤ | D.全部 |
化学品船是建造或改装用于运载各种有毒、易燃、易挥发或有腐蚀性的化学物质的货船,下列说法错误的是
| A.在船舶的底部四周镶嵌铜块以保护船体 |
| B.不锈钢船舱可储藏运输散装氢氧化钠溶液 |
| C.甲醇与浓硫酸必须分开储藏运输 |
| D.造船焊接钢板时可用二氧化碳保护气 |
下列做法有利于金属防护的是( )
| A.钢铁零件表面进行烤蓝处理 |
| B.将钢铁制成的闸门与直流电源正极相连 |
| C.菜刀切菜后不洗净就放回刀架 |
| D.埋在地下的钢管与铜块相连 |
制造焊锡时,把铅加进锡的重要原因是
| A.增加强度 | B.降低熔点 | C.增加硬度 | D.增强抗腐蚀能力 |
化学用语是学习化学的重要工具,下列化学用语中正确的是
A.Na2S的水解:S2-+ 2H2O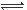 H2S + 2OH- H2S + 2OH- |
B.NaHCO3的电离:NaHCO3 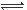 Na + + H+ + CO32- Na + + H+ + CO32- |
C.HSO3-的电离:HSO3- 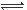 H+ + SO32- H+ + SO32- |
| D.钢铁的电化学腐蚀的负极反应式:Fe-3e-Fe3+ |
下列叙述错误的是
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.铁在潮湿空气中发生腐蚀,其负极反应是2H++2e-=H2↑ |
| C.用锡焊接的铁质器件,焊接处易生锈 |
| D.铁管上镶嵌锌块,铁管不易被腐蚀 |
下列叙述的原因不是由于原电池造成的是
| A.运输液氯的铁管被腐蚀 | B.金属在潮湿空气中更容易腐蚀 |
| C.铁与酸反应滴加硫酸铜后反应加快 | D.含杂质的锌比纯锌与酸反应快 |