下列说法或表述正确的是( )
①过氧化钠中阳离子和阴离子个数比为1:1
②纯碱既属于正盐又属于钠盐和碳酸盐。
③相同温度下,氢氧化钠溶液的导电能力比氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应。
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-=Fe2+
| A.①②④⑤ | B.②③④ | C.②④⑤ | D.③④⑤ |
寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量,以下分析错误的是
| A.将化学能转化为热能 |
| B.铁作负极,电极反应为:Fe – 3e → Fe3+ |
| C.其发热原理与钢铁的吸氧腐蚀相同 |
| D.活性炭作正极,电极反应为:2H2O + O2 + 4e → 4OH- |
下列叙述正确的是 
| A.装置甲可防止铁钉生锈 |
| B.装置乙可除去CO2中混有的SO2 |
| C.装置丙可验证HCl气体在水中的溶解性 |
| D.装置丁可用于实验室制取乙酸乙酯 |
下列陈述Ⅰ、Ⅱ都正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
非金属性:Cl>S |
酸性:HClO> H2SO3 |
| B |
SO2有氧化性 |
SO2能使酸性KMnO4溶液褪色 |
| C |
NH3.H2O为一元弱碱 |
含有NH4+的水溶液均显弱碱性 |
| D |
锌的金属性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
下列叙述正确的是
| A.氢氧燃料电池中O2通入负极 |
| B.铅蓄电池在放电时,其负极的电极反应为:Pb-2e=Pb2+ |
| C.碱性锌锰电池在工作时,电解质中的OH-移向正极 |
| D.在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列与金属腐蚀有关的说法正确的是( )
| A.图a中,插入海水中的铁棒越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
如图所示的装置中,金属a能从酸中置换出H2,b为碳棒,关于此装置的各种叙述中不正确的是( )
| A.碳棒上有气体放出,溶液pH值变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |
下列物质的说法正确的是
| A.芳香烃可以来自于煤干馏产品中的煤焦油 |
| B.聚氯乙烯可用于制作食品包装袋 |
| C.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 |
| D.在铁的吸氧腐蚀中,负极是炭,电极反应为2H2O+O2+4eˉ=" 4OHˉ" |
结合下图判断,下列叙述正确的是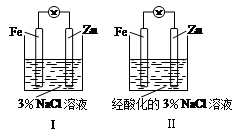
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是:Fe-2e-===Fe2+ |
| C.Ⅰ正极反应是:O2 + 2H2O + 4e-===4OH- |
| D.Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 | D.地下钢管连接镁块 |
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是 
| A.正极的电极方程式为:O2+2H2O+4e-===4OH- |
| B.将石墨电极改成Mg电极,难以观察到铁锈生成 |
| C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 |
| D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 |
下列叙述错误的是( )
| A.废弃的干电池不能随意丢弃,但可以土埋处理 |
| B.马口铁(镀锡铁)镀层破损后即失去保护作用 |
| C.不能将铁制自来水管与铜制水龙头连接使用 |
| D.电化学腐蚀过程中存在电极反应,产生微电流 |
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
下列有关金属铁的腐蚀与防护,说法正确的是
| A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.铁与电源正极连接可实现电化学保护 |
| D.将钢管与铜管一起堆放时可保护钢管少受腐蚀 |