下列说法正确的是
| A.SO2的水溶液能导电,所以SO2是电解质 |
| B.CaCO3的水溶液不能导电,所以CaCO3是非电解质 |
| C.浓度均为0.1mol/L的盐酸和氢氧化钠溶液等体积混合,混合后溶液导电性不变 |
| D.向0.2mol/L的氯化钡溶液中逐滴滴入同浓度的硫酸钠溶液至过量,溶液的导电性先减小后增大 |
不用其它试剂鉴别①KNO3 ②Ba(OH)2 ③MgSO4 ④CuSO4四种溶液,正确的鉴别顺序是
| A.①④③② | B.④①③② | C.④②③① | D.①③④② |
下列观点正确的是
| A.化合物电离时,生成的阴离子是氢氧根离子的是碱 |
| B.某化合物的熔融状态能导电,该化合物中一定有离子键 |
| C.某化合物的水溶液能导电,该化合物一定是电解质 |
| D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 |
下列说法中,正确的是
| A.含金属元素的离子不一定是阳离子 |
| B.金属与盐溶液反应都是置换反应 |
| C.玻璃是氧化物,成分可表示成Na2O.CaO.6SiO2 |
| D.与强酸、强碱都反应的物质只有两性氧化物和两性氢氧化物 |
下列叙述正确的是
| A.强电解质都是离子化合物,因此NaCl是离子化合物 |
| B.醋酸溶液的导电能力可能比稀硫酸强 |
| C.SO3的水溶液能导电,SO3是电解质 |
| D.硫磺不导电,因此硫磺是非电解质 |
下列物质中既能导电,又属于电解质的是
| A.氯化钠溶液 | B.金属铜 | C.熔融硝酸钾 | D.酒精 |
用如图所示装置分别进行如下实验,测定导电性变化,溶液导电能力明显增强的是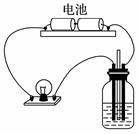
| A.向AgNO3溶液中通入少量HCl | B.向H2SO3溶液中通入Cl2 |
| C.向FeI2溶液中通入少量Cl2 | D.向NaOH溶液中通入少量Cl2 |
把200 mL含有CaCl2和KCl的混合溶液分成2等份,取一份加入含2a mol 碳酸钠的溶液,恰好使钙离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A.0.1(b-4a)mol/L | B.0.1(b-2a)mol/L |
| C.10(b-4a)mol/L | D.10(b-2a)mol/L |
下列说法正确的是
| A.强电解质溶液的导电性比弱电解质溶液的导电性强 |
| B.BaSO4投入水中,导电性较弱,故它是弱电解质 |
| C.弱电解质溶液中存在两种共价化合物分子 |
| D.强电解质都是离子化合物,弱电解质都是共价化合物 |
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
| A.根据纯净物的元素组成,将纯净物分为单质和化合物 |
| B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 |
下列表中对于相关物质的分类全部正确的一组是
| 编号 |
纯净物 |
混合物 |
弱电解质 |
非电解质 |
| A |
明矾 |
蔗糖 |
NaHCO3 |
CO2 |
| B |
天然橡胶 |
石膏 |
SO2 |
CH3CH2OH |
| C |
冰 |
王水 |
H2SiO3 |
Cl2 |
| D |
胆矾 |
玻璃 |
H2CO3 |
NH3 |
下列说法正确的是:①电解质溶液导电过程属于化学变化,②酸性氧化物都是非金属氧化物③FeC12、Fe(OH)3、Fe3O4都能通过化合反应来制取 ④Na2O2不是碱性氧化物
| A.②③④ | B.①④ | C.①③④ | D.②③ |
下列有关电解质的叙述中错误的是
| A.强电解质在水溶液里或熔融状态时的电离方式是一样的 |
| B.弱电解质溶液可能比强电解质溶液的导电性强 |
| C.HCl是强电解质,它只能在水溶液里才能电离 |
| D.电解质溶液导电过程中必然伴随化学变化 |