某化学学习小组欲设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(预计H2的体积6mL左右)同时检验氯气的氧化性。现有以下的仪器可供选择: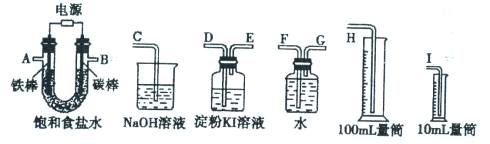
(1)若要完成以上的实验,将所给仪器连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接 、 接 ,B 接 、 接 。
( 2)能说明氯气具有氧化性的实验现象是 。
(3)已知氯气溶于水中有如下平衡:Cl2+H2O HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。
HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。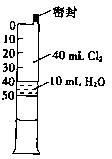
①若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是 。
②用化学平衡的观点解释①的现象:
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为__ __。
在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为 。
(2)阴极上的电极反应式为 。
(3)原上层液体是 。
(4)原下层液体是 。
(5)搅拌后两层液体颜色发生变化的原因是 。
(6)要检验上层液体中含有的金属离子 ,现象是 。
如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。
试回答:
(1)a为 极,c极的电极反应式为: 。
(2)电解开始时,在B烧杯的中央滴几滴淀粉溶液,你能观察到的现象是

 。电解进行一段时
。电解进行一段时
间后,罩在c极上的试管中 也收集到了气体,此时c极上的电极反应式为: 。
也收集到了气体,此时c极上的电极反应式为: 。
(3)当d电极上收集到44.8 ml气体(标准状况)时停止电解,a极上放出了 mol气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 。若要使A池中溶液恢复原浓度,应加 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200 ml,取这种溶液加入到25.0 ml 0.100 mol·L-1的HCl溶液中,当加入31.25 ml 溶液时刚好沉淀完全。由此可知电解前A烧杯中MNO3 溶液的物质的量浓度为 mol·L-1。
溶液的物质的量浓度为 mol·L-1。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”,请就“三大酸”的性质,回答下列问题:
⑴稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为________________________________________________________。
某同学未加入氧化剂,而是 设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
⑵某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
 |
①若要测定NO的体积,从上图所示的装置中,你认为应选用 装置进行Cu与浓硝酸反应实验,选用的理由是 。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为 L。
高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于饮用水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极产生高铁酸钠的电极反应方程式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是 。研究亦发现,铁电极在某一电压范围内会产生氧气使阳极表面生成Fe2O3膜而“钝化”。写出产生O2的电极反应方程式: 。
(3)FeO42—易与水4h生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图中4h后)过滤掉氢氧化铁,反应过程中FeO42—浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是 (填编号)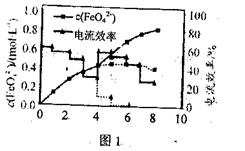
①过滤:掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
②过滤掉氢氧化铁对电流效率影响不大
③实验表明不过滤掉氢氧化铁,6h后电流效率几乎为0
(4)在相同的pH条件下,经过相同的反应时间,高铁酸盐的产率与温度关系如图2。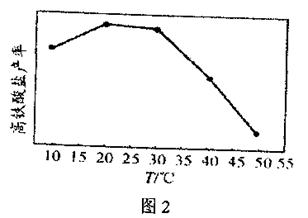
随温度升高,高铁酸盐产率先增大后减小的原因是 。
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值有 (至少答一点)。