①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极,②④相连时,②有气泡逸出;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是:
| A.①③②④ | B.③④②① | C.①③④② | D.③①②④ |
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是 ( )
| A.原电池是将化学能转化成电能的装置 |
| B.原电池由电极、电解质溶液和导线等组成 |
| C.右图中a极为铝条、b极为锌片时,导线中会产生电流 |
| D.右图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
下列关于右图所示原电池装置的叙述中,正确的是( )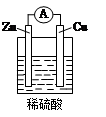
| A.铜片是负极 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
某实验兴趣小组用如图所示装置做完实验后,在读书卡片上记下了如下6条记录,其中合理的是

| A.①②③ | B.③④⑤ | C.④⑤⑥ | D.②③④ |
关于锌铜—稀硫酸原电池的叙述,错误的是
| A.锌是正极,其质量逐渐减小 | B.电流从锌片经导线流向铜片 |
| C.电子从锌片经导线流向铜片 | D.氢离子在铜表面被还原,产生气泡 |
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为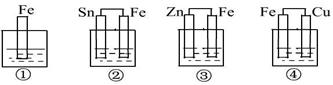
| A.②①③④ | B.④③①② | C.④②①③ | D.③②④① |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b用导线连接时,SO42-向铜电极移动 |
如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
| A.锌是正极,MnO2是负极 | B.锌是负极,MnO2是正极 |
| C.锌是正极,石墨棒是负极 | D.锌是负极,石墨棒是正极 |
将银棒和锌棒用导线连接插入AgNO3溶液中,当导线中有0.2 mol电子通过时,负极质量的变化是( )
| A.增加6.5 g | B.减少6.5 g | C.增加21.6g | D.减少21.6g |
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是 ( )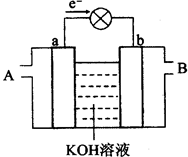
| A.A处通入空气,B处通入水煤气 |
| B.a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C.a电极发生还原反应,b电极发生氧化反应 |
| D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24 L |
在理论上不能用于设计原电池的化学反应是
| A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s) △H<0 |
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2O(l) △H<0 2CO2(g)+3H2O(l) △H<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0 |
| D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l) △H<0 |
原电池是将化学能直接转化为电能的装置,原电池反应的本质是
| A.化合价的升降 | B.离子定向移动 |
| C.氧化还原反应 | D.电能的储存 |